Ixazomib: perorálny inhibítor proteazómu v liečbe mnohopočetného myelómu
prof. doc. MUDr. Ivan Špička, CSc.
Mnohopočetný myelóm (MM) je druhou najčastejšou hematologickou malignitou. Podľa nedávnych štatistických údajov je v populácii riziko jeho vzniku v priebehu života 0,7 % (1). Vďaka zlepšeniu diagnostických metód a hlavne pokroku v liečbe sa prognóza pacientov s MM v posledných 15 rokoch zlepšila zo všetkých nádorových ochorení možno najviac. Pravdepodobnosť 5-ročného prežitia sa zvýšila z 25 % v 70. rokoch minulého storočia na súčasných viac než 46 % (2).
Toto zlepšenie súvisí so zavedením prvých generácií dvoch hlavných skupín biologických liekov s protimyelómovým účinkom – inhibítorov proteazómu (PI) a imunomodulačných liekov (IMID-ov). Režimy s oboma týmito triedami liekov v kombinácii s autológnou transplantáciou kmeňových buniek vedú k viac než 90 % terapeutickej odpovedi, pri viac než 50 % pravdepodobnosti dosiahnutia kompletnej remisie (CR) (3). Za podmienky plného využitia potenciálu nových liekov je podľa niektorých autorov obdobie 10 rokov predikovaným mediánom času prežitia pacientov s MM. Napriek tomu musíme považovať MM za stále nevyliečiteľné ochorenie. Zmenu tejto skutočnosti by mali priniesť biologické lieky novej generácie, ktoré sú uvádzané do klinickej praxe v ostatných 2 – 3 rokoch. Môžeme ich rozdeliť do niekoľkých skupín: a) lieky novej generácie PI a IMiD-ov, ktoré vykazujú vyššiu účinnosť a menšiu toxicitu (4) b) monoklonové protilátky c) ostatné. Za prevratný sa v literatúre označuje rok 2015, kedy boli do klinickej praxe schválením FDA povolené hneď 4 nové lieky: inhibítor proteazómu ixazomib, monoklonové protilátky daratumumab a elotuzumab a inhibítor HDACC panobinostat.
Proteazóm je integrálny regulátor vnútrobunkových signálov. Poškodenie degradácie a recyklácie proteínov závislých od proteazómu naruší základné procesy ovplyvňujúce bunkový cyklus, bunkovú diferenciáciu a bunkovú apoptózu (5). Prvý inhibítor proteazómu schválený pre liečbu MM a lymfómu z plášťových buniek bol bortezomib (BTZ), derivát kyseliny borónovej. Jeho zásadný prínos je nepochybný a viedol k snahe o syntézu ďalších PI druhej generácie. Ixazomib, predtým označovaný ako MLN 9708, je prvý perorálny inhibítor proteazómu uvedený do klinickej praxe. Rovnako ako bortezomib ide o reverzibilný inhibítor obsahujúci boronát, s podstatne kratším disociačným časom (18 minút proti 110 min. v prípade BTZ), čo je spájané s výborným prienikom do tkanív (6). Obdobne ako v prípade BTZ jeho hlavným efektom je inhibícia chymotrypsin-like aktivity beta 5 podjednotky 20S proteazómu. Vo vyšších koncentráciách inhibuje taktiež kaspáza-like aktivitu beta 1 podjednotky a trypsín-like beta 2 podjednotky (7).
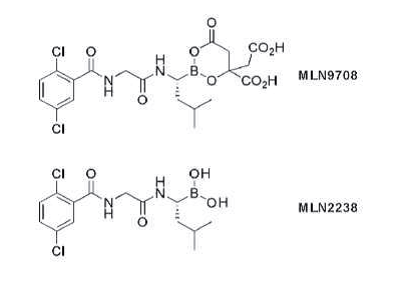
V predklinických štúdiách preukázalo porovnanie MLN2238 (na ktorý sa MLN9708 v plazme či roztoku rýchlo hydrolyzuje) a BTZ v prípade xenograftových modelov MM, lymfómu a Ca prostaty vyššiu kapacitu MLN2238 v schopnosti regresie tumorov a signifikantné predĺženie prežitia pokusných populácií myší. Preklinické štúdie taktiež ukázali, že je účinný aj proti bortezomib-rezistentným bunkovým líniám a má synergický efekt s ďalšími protimyelómovými liekmi (8).
Stanovenie účinného a bezpečného dávkovania bolo skúmané v niekoľkých paralelných klinických štúdiách fázy 1 a 1/2. Skrátene môžeme ich výsledky zhrnúť tak, že ako podanie 1× alebo 2× týždenne bolo sprevádzané zvládnuteľnou toxicitou (stupeň 3 hlavne trombocytopénia, hnačky, slabosť, nauzea) a čo je nutné zdôrazniť, k minimálnemu výskytu závažnejšej neuropatie (stupeň 3 u 0 %, 4 %, resp. 6 %) (9). Štúdia kombinácie s melfalanom a prednizónom viedla k odporúčanej dávke MLN9708 4 mg 1× týždenne (10) pre fázu 2.
K schváleniu asociáciou FDA na klinické použitie v roku 2015 viedli výsledky štúdie fázy 3 TOURMALINE-MM1, ktorá u 722 pacientov po 1 – 3 líniách terapie porovnávala kombináciu ixazomibu, lenalidomidu a dexametazónu (IRD) proti kontrole RD + placebo . Štúdia ukázala signifikantné predĺženie PFS z 20,6 mesiaca pri IRD proti 14,7 mesiaca pri RD (p = 0,012). Celková odpoveď bola 78,3 % s mediánom trvania 20,5 mesiaca vs 71,5 % počas 15 mesiacov v kontrolnom ramene. Pomer CR + VGPR bol 48 % proti 39 % v prípade kontrol, nástup účinku bol v sledovanej skupine skoro o polovicu rýchlejší (1,1 mesiaca vs 1,9 mesiaca). Dôležitým faktom je, že medián PFS bol podobný u chorých s vysokým aj štandardným cytogenetickým rizikom. Najčastejšími nežiaducimi účinkami stupňa ≥ 3 boli neutropénia, anémia, trombocytopénia a pneumónia, ich súhrnná frekvencia však bola porovnateľná (73 % vs 69 %). Jedinou výnimkou bola závažnejšia trombocytopénia st. 3,4, častejšia pri terapii ILD (19 % vs 9 %). Rovnako ako v predchádzajúcich štúdiách nebola pozorovaná signifikantne vyššia incidencia periférnej neuropatie (PN) u pacientov liečených proteazómovým inhibítorom (27 % vs 22 % celkovo, v prípade stupňa 3 u 2 % v oboch skupinách) (11). Tieto výsledky potvrdila taktiež následná regionálna štúdia v Číne, v ktorej bolo celkové prežitie pacientov liečených IRD 25,8 mesiaca proti 15,8 v skupine kontrolnej (HR 0,419; p = 0,001) (12). V súčasnosti je ixazomib schválený na klinické použitie vo viac než 40 krajinách sveta.
Celosvetovo teraz prebieha celý rad štúdií s ixazomibom v ďalších možných kombináciách (13).
Udržiavacia liečba sa už niekoľko rokov považuje za integrálnu súčasť terapie MM. Musí spĺňať 3 hlavné podmienky – jednoduchosť podania, limitovanú toxicitu a dlhodobú účinnosť. Hlavným liekom pre udržiavaciu liečbu je v súčasnosti lenalidomid (LEN), ktorého dlhodobé podávanie vedie k výraznému predĺženiu času do progresie. I keď niektoré dáta svedčia pre vyšší efekt inhibítorov proteazómu u pacientov s rizikovými cytogenetickými zmenami, parenterálne podávanie a taktiež častosť nežiaducich účinkov môže limitovať BTZ pre túto indikáciu. Kombinácia LEN a BTZ síce ďalej predlžuje parametre prežitia u rizikových chorých (32 mesiacov PFS, 93 % prežitie v 3 rokoch), no opäť za cenu toxicity a nepohodlia pre pacientov (6).
V súčasnosti prebiehajú dve štúdie zamerané na udržiavaciu liečbu ixazomibom u pacientov po ATKD (TOURMALINE-MM3) a bez nej (TOURMALINE-MM4) (13).
Referencie:
(1) Leonard Naymagon and Maher Abdul-Hay. Novel agents in the treatment of multiple myeloma: a review about the future. J Hematol Oncol. 2016; 9: 52.
(2) Surveillance, Epidemiology, and End Results Program Turning Cancer Data Into Discovery. 2015 [cited 2015 October 22]; Myeloma. Surveillance, Epidemiology, and End Results Program. Available from: http://seer.cancer.gov/statfacts/html/mulmy.html. Accessed 27 Nov 2017
(3) Attal M, Lauwers-Cances V, Hulin C, Leleu X, Caillot D, Escoffre M, Arnulf B, Macro M, Belhadj K, Garderet L, Roussel M, Payen C, Mathiot C, Fermand JP, Meuleman N, Rollet S, Maglio ME, Zeytoonjian AA, Weller EA, Munshi N, Anderson KC, Richardson PG, Facon T, Avet-Loiseau H, Harousseau JL, Moreau P; IFM 2009 Study. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma. N Engl J Med. 2017 Apr 6; 376(14): 1311 – 1320. doi: 10.1056/NEJMoa1611750
(4) Stewart AK, Rajkumar S. V., Dimopoulos M. A., Masszi T., Špička I., Oriol A., Hájek R., Rosiñol L., Siegel D. S., Mihaylov G. G., Goranova-Marinova V., Rajnics P., Suvorov A., Niesvizky R., Jakubowiak A. J., San-Miguel J. F., Ludwig H., Wang M., Maisnar V., Minarik J., Bensinger W. I., Mateos M. V., Ben-Yehuda D., Kukreti V., Zojwalla N., Tonda M. E., Yang X., Xing B., Moreau P., Palumbo A.; ASPIRE Investigators. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med. 2015 Jan 8; 372(2): 142 – 52. doi: 10.1056/NEJMoa1411321. Epub 2014 Dec 6.
(5) Chauhan D., Hideshima T., Mitsiades C., Richardson P., Anderson K. C. Proteasome inhibitor therapy in multiple myeloma. Mol Cancer Ther. 2005; 4(4): 686 – 692.
(6) Brayer J. and Baz R. The potential of ixazomib, a second-generation proteasome inhibitor, in the treatment of multiple myeloma. Ther Adv Hematol. 2017 Jul; 8(7): 209 – 220.
(7) Kupperman E., Lee E. C., Cao Y., et al. Evaluation of the proteasome inhibitor MLN9708 in preclinical models of human cancer. Cancer Res 2010; 70: 1970 – 1980
(8) Offidani M., Corvatta L., Caraffa P., Gentili S., Maracci L., Leoni P. An evidence-based review of ixazomib citrate and its potential in the treatment of newly diagnosed multiple myeloma. Onco Targets Ther. 2014 Sep 29; 7: 1793 – 800. doi: 10.2147/OTT.S49187. eCollection 2014.
(9) Richardson P. G., Baz R., Wang M., et al. Phase 1 study of twice-weekly ixazomib, an oral proteasome inhibitor, in relapsed/refractory multiple myeloma patients. Blood 2014; 124: 1038 – 1046.
(10) San Miguel J., Gutierrez M. A. E., Špicka I., Mateos M.-V., Song K., Craig M., Bladé J., Hájek R., Chen C., Gupta N., Byrne C., Lu V., van de Velde H., Lonial S. THE ORAL PROTEASOME INHIBITOR IXAZOMIB IN COMBINATION WITH MELPHALAN-PREDNISONE (MP) FOR PATIENTS (PTS) WITH NEWLY DIAGNOSED MULTIPLE MYELOMA (NDMM): PHASE 1/2 DOSE-ESCALATION STUDY (NCT01335685) Abstract: P339 (Abstract release date: May 18, 2017) EHA Learning Center. San Miguel J. Jun 23, 2017; 181626
(11) Moreau P., Masszi T., Grzasko N., Bahlis N. J., Hansson M., Pour L., Sandhu I., Ganly P., Baker B. W., Jackson S. R., Stoppa A. M., Simpson D. R., Gimsing P., Palumbo A., Garderet L, Cavo M., Kumar S., Touzeau C., Buadi F. K., Laubach J. P., Berg D. T., Lin J., Di Bacco A., Hui A. M., van de Velde H., Richardson P. G.; TOURMALINE-MM1 Study Group. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016 Apr 28; 374(17): 1621 – 34. doi: 10.1056/NEJMoa1516282.
(12) Hou J., Jin J., Xu Y., Wu D., Ke X, Zhou D., Lu J., Du X., Chen X., Li J., Liu J., Gupta N., Hanley M. J., Li H., Hua Z., Wang B., Zhang X., Wang H., van de Velde H., Richardson P. G., Moreau P. Randomized, double-blind, placebo-controlled phase III study of ixazomib plus lenalidomide-dexamethasone in patients with relapsed/refractory multiple myeloma: China Continuation study. J Hematol Oncol. 2017 Jul 6; 10(1): 137. doi: 10.1186/s13045-017-0501-4.
(13) www.clinicaltrials.gov
NINLARO – MOA
NINLARO - MOA Mnohopočetný myelóm je devastujúce, relabujúce a nevyliečiteľné nádorové ochorenie, ktoré predstavuje približne 1 % všetkých nádorových
Mnohopočetný myelóm v číslach
Mnohopočetný myelóm v číslach
Mnohopočetný myelóm v číslach
Mnohopočetný myelóm v číslach
Mohlo by Vás zajímat
NINLARO
NINLARO 2,3 mg tvrdé kapsuly; NINLARO 3 mg tvrdé kapsuly; NINLARO 4 mg tvrdé kapsuly
Skrátená informácia o lieku
▼ Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie.
Zloženie: NINLARO 2,3 mg tvrdé kapsuly. Každá kapsula obsahuje 2,3 mg ixazomibu (vo forme 3,3 mg ixazomíbiumcitrátu). NINLARO 3 mg tvrdé kapsuly. Každá kapsula obsahuje 3 mg ixazomibu (vo forme 4,3 mg ixazomíbiumcitrátu). NINLARO 4 mg tvrdé kapsuly. Každá kapsula obsahuje 4 mg ixazomibu (vo forme 5,7 mg ixazomíbiumcitrátu) Pomocné látky: pozrite v SPC Indikácie: NINLARO je v kombinácii s lenalidomidom a dexametazónom indikovaný na liečbu dospelých pacientov s mnohopočetným myelómom, ktorí dostali aspoň jednu predchádzajúcu liečbu. Dávkovanie a spôsob podávania: Odporúčaná úvodná dávka ixazomibu je 4 mg podávaná perorálne, jedenkrát týždenne v 1, 8. a 15. deň 28-dňového liečebného cyklu. Odporúčaná úvodná dávka lenalidomidu je 25 mg podávaná denne v 1. až 21. deň 28-dňového liečebného cyklu. Odporúčaná úvodná dávka dexametazónu je 40 mg podávaná v 1., 8., 15. a 22. deň 28-dňového liečebného cyklu. Pred začatím nového liečebného cyklu: absolútny počet neutrofilov má byť ≥ 1 000/mm3, počet trombocytov má byť ≥ 75 000/mm3, nehematologické toxicity majú byť podľa uváženia lekára späť na počiatočnom stave alebo ≤ 1. stupňa. V liečbe sa má pokračovať až do progresie ochorenia alebo výskytu neakceptovateľnej toxicity. V prípade oneskorenia alebo vynechania dávky ixazomibu sa má dávka užiť iba ak je ďalšia dávka plánovaná za ≥ 72 hodín. Vynechaná dávka sa nemá užiť v priebehu 72 hodín od ďalšej plánovanej dávky. Nemá sa užiť dvojnásobná dávka, aby sa nahradila vynechaná dávka. Ak pacient po užití dávky vracia, nemá užiť ďalšiu dávku, ale má pokračovať v dávkovaní v čase ďalšej plánovanej dávky. Úpravy dávky: Odporúčaná je znížená dávka 3 mg v prítomnosti stredného alebo ťažkého poškodenia pečene, ťažkého poškodenia obličiek alebo ochorenia obličiek v poslednom štádiu (End-Stage Renal Disease, ESRD) vyžadujúceho dialýzu. Striedanie úprav dávky sa odporúča pre ixazomib a lenalidomid pri prekrývajúcich sa toxicitách trombocytopénie, neutropénie a vyrážky. Pre tieto toxicity je prvým krokom úpravy dávky prerušenie/zníženie dávky lenalidomidu. Ohľadne krokov na zníženie dávky pre tieto toxicity si prečítajte SPC lenalidomidu. Súbežne podávané lieky :U pacientov liečených ixazomibom sa má zvážiť antivírusová prevencia na zníženie rizika reaktivácie herpesu zoster. U pacientov zahrnutých do štúdií s ixazomibom, ktorí dostávali antivírusovú prevenciu, bol výskyt infekcie herpesom zoster nižší v porovnaní s pacientmi, ktorí antivírusovú prevenciu nedostávali. Prevencia trombózy sa odporúča u pacientov liečených ixazomibomv kombinácii s lenalidomidom a dexametazónom a má sa zakladať na vyhodnotení existujúcich rizík a klinického stavu pacienta- Starší pacienti: Pre pacientov starších ako 65 rokov nie je potrebná žiadna úprava dávky ixazomibu. Poškodenie pečene :Nie je potrebná žiadna úprava dávky ixazomibu u pacientov s miernym poškodením pečene Poškodenie obličiek :U pacientov s ľahkým alebo stredným poškodením obličiek (klírens kreatinínu ≥ 30 ml/min) nie je potrebná žiadna úprava dávky ixazomibu. Znížená dávka 3 mg sa odporúča u pacientov s ťažkým poškodením obličiek (klírens kreatinínu < 30 ml/min) alebo s ochorením obličiek v poslednom štádiu (ESRD) vyžadujúcom dialýzu. Ixazomib sa neodstraňuje dialýzou a preto sa môže podávať bez ohľadu na načasovanie dialýzy. Kontraindikácie: Precitlivenosť na aktívnu látku alebo ktorúkoľvek z pomocných látok. Osobitné upozornenia a opatrenia pri používaní: Keďže sa ixazomib podáva v kombinácii s lenalidomidom a dexametazónom, prečítajte si ohľadne ďalších osobitných upozornení a opatrení pri používaní súhrn charakteristických vlastností týchto liekov. Pri liečbe liekom ixazomib sa hlásila trombocytopénia s minimálnymi hodnotami trombocytov vyskytujúcimi sa typicky medzi 14. – 21. dňom každého 28-dňového cyklu a navrátením hodnôt na počiatočnú hodnotu na začiatku ďalšieho cyklu. Pri liečbe liekom ixazomib sa hlásili hnačka, zápcha, nevoľnosť a vracanie, ktoré niekedy vyžadovali použitie antiemetík a liekov proti hnačke, ako aj podpornú liečbu . Pri ťažkých (3. – 4. stupeň) príznakoch sa má upraviť dávka. V prípade ťažkých gastrointestinálnych príhod sa odporúča sledovanie koncentrácií draslíka v sére. S ixazomibom sa hlásil výskyt periférnej neuropatie (pozri časť 4.8). U pacienta sa majú sledovať príznaky periférnej neuropatie. U pacientov, u ktorých sa vyskytne nový prípad periférnej neuropatie alebo u ktorých dôjde k jej zhoršeniu, môže byť potrebná úprava dávky. S ixazomibom sa hlásil výskyt periférneho edému (pozri časť 4.8). U pacienta sa majú vyhodnotiť základné príčiny a podľa potreby sa mu má poskytnúť podporná liečba. Dávka dexametazónu sa má upraviť podľa predpisovej informácie ixazomibu pre príznaky 3. alebo 4. stupňa ( s ixazomibom sa hlásil výskyt vyrážky (pozri časť 4.8). Vyrážka sa má liečiť podpornou starostlivosťou, alebo v prípade výskytu 2. alebo vyššieho stupňa, úpravou dávky. S ixazomibom sa menej často hlásil výskyt poškodenia pečene spôsobeného liekom, hepatocelulárneho poškodenia, steatózy pečene, cholestatickej hepatitídy a hepatotoxicity (pozri časť 4.8). Majú sa pravidelne sledovať pečeňové enzýmy a v prípade výskytu príznakov 3. alebo 4. stupňa sa má upraviť dávka. Ženy sa počas liečby ixazomibom musia vyhnúť otehotneniu. U pacientov dostávajúcich ixazomib sa vyskytol syndróm posteriórnej reverzibilnej encefalopatie (Posterior Reversible Encephalopathy Syndrome, PRES). U pacientov, u ktorých sa vyvinul PRES, sa má ukončiť liečba Ixazomibom . Silné induktory môžu znižovať účinnosť ixazomibu, preto sa treba vyhnúť súbežnému používaniu silných induktorov CYP3A ako sú karbamazepín, fenytoín, rifampicín a ľubovník bodkovaný (Hypericum perforatum). Liekové a iné interakcie: Inhibítory CYP :Súbežné podávanie ixazomibu s klaritromycínom, silným inhibítorom CYP3A, neviedlo ku klinicky významnej zmene systémovej expozície ixazomibu. Hodnota Cmax ixazomibu sa znížila o 4 % a hodnota AUC ixazomibu sa zvýšila o 11 %. Preto nie je pri súbežnom podávaní so silnými inhibítormi CYP3A potrebná žiadna úprava dávky ixazomibu. Induktory CYP :Súbežné podávanie ixazomibu s rifampicínom znížilo hodnotu Cmax ixazomibu o 54 % a hodnotu AUC ixazomibu o 74 %. Preto sa súbežné podávanie silných induktorov CYP3A s ixazomibom neodporúča. Ixazomib nie je reverzibilným ani časovo závislým inhibítorom CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 alebo 3A4/5. Ixazomib neindukoval aktivitu CYP1A2, CYP2B6 ani CYP3A4/5 ani zodpovedajúce hladiny imunoreaktívnych proteínov. Neočakávajú sa liekové interakcie ixazomibu prostredníctvom inhibície alebo indukcie CYP. Interakcie zakladajúce sa na transportéroch: Ixazomib je substrátom P-gp s nízkou afinitou. Ixazomib nie je substrátom BCRP, MRP2 ani pečeňových OATP. Ixazomib nie je inhibítorom P-gp, BCRP, MRP2, OATP1B1, OATP1B3, OCT2, OAT1, OAT3, MATE1 ani MATE2-K. Neočakávajú sa liekové interakcie ixazomibu sprostredkované transportérmi. Perorálna antikoncepcia: Pri súbežnom podávaní ixazomibu s dexametazónom, ktorý je známym slabým až stredným induktorom CYP3A4, ako aj iných enzýmov a transportérov, treba zvážiť riziko zníženej účinnosti perorálnej antikoncepcie. Ženy používajúce hormonálnu antikoncepciu majú dodatočne používať bariérovú antikoncepčnú metódu. Fertilita, gravidita,dojčenie: Keďže ixazomib sa podáva v kombinácii s lenalidomidom a dexametazónom, ohľadne ďalších informácií o fertilite, gravidite a dojčení si prečítajte súhrn charakteristických vlastností týchto liekov. Ženy vo fertilnom veku/antikoncepcia u mužov a žien :Muži aj ženy, ktorí sú schopní splodiť dieťa, musia používať účinné antikoncepčné metódy počas liečby a 90 dní po liečbe. Ixazomib sa neodporúča užívať u žien vo fertilnom veku nepoužívajúcich antikoncepciu. Pri súbežnom podávaní ixazomibu s dexametazónom, ktorý je známym slabým až stredným induktorom CYP3A4, ako aj iných enzýmov a transportérov, treba zvážiť riziko zníženej účinnosti perorálnej antikoncepcie. Preto majú ženy používajúce perorálnu hormonálnu antikoncepciu dodatočne používať bariérovú antikoncepčnú metódu. Fertilita:Štúdie fertility neboli s ixazomibom uskutočnené Gravidita: ixazomib sa neodporúča používať počas gravidity, pretože môže pri podávaní gravidným ženám spôsobiť poškodenie plodu. Preto sa majú ženy počas liečby ixazomibom vyhnúť otehotneniu. Nie sú k dispozícii údaje o použití ixazomibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu. Dojčenie :Nie je známe, či sa ixazomib alebo jeho metabolity vylučujú do ľudského mlieka. K dispozícii nie sú žiadne údaje získané u zvierat. Riziko u novorodencov/dojčiat nemôže byť vylúčené a preto má byť laktácia ukončená. Ixazomib sa podáva v kombinácii s lenalidomidom. Lenalidomid je štrukturálne príbuzný s talidomidom. Talidomid je známa teratogénne aktívna látka u ľudí, ktorá spôsobuje život ohrozujúce vrodené vady. Pri užívaní lenalidomidu počas tehotenstva sa u ľudí očakáva teratogénny účinok. Ak neexistuje spoľahlivý dôkaz o neplodnosti pacienta, podmienky programu na zabránenie otehotnenia pre lenalidomid sa musia dodržiavať u všetkých pacientov. Prečítajte si aktuálny súhrn charakteristických vlastností lieku. Nežiaduce účinky : Keďže sa ixazomib podáva v kombinácii s lenalidomidom a dexametazónom, prečítajte si ohľadne ďalších nežiaducich účinkov súhrn charakteristických vlastností týchto liekov. Veľmi časté: infekcie horných dýchacích ciest, trombocytopénia, neutropénia, periférna neuropatia, hnačka, nauzea, vracenie, zápcha, vyrážka, bolesť chrbáta, periférny edém. Časté: Herpes zoster. Ukončenie liečby: U každého nežiadúceho účinku došlo k ukončeniu liečby jedným nebo niekoľkými z troch liekov u ≤ 1 % pacientov v režime s ixazomibom. Trombocytopénia: U troch percent pacientov s režimom NINLARO a u 1 % pacientov v režime s placebom bol v priebehu liečby počet krvných doštičiek ≤ 10 000/mm3. Menej ako 1 % pacientov v oboch režimoch malo počas liečby počet krvných doštičiek ≤ 5 000/mm3. K ukončeniu liečby jedným nebo niekoľkými z troch liekov došlo pre trombocytopéniu u < 1 % pacientov v režime s ixazomibom a u 2 % pacientov v režime s placebom. Trombocytopénia neviedla k vzostupu hemoragických príhod ani transfúzii krvných doštičiek. Gastrointestinálna toxicita: Hnačka viedla k ukončeniu liečby jedným abo niekoľkými z troch liekov u 1 % pacientov v režime s NINLARO a u < 1 % pacientov v režime s placebom. Ostatné nežiaduce účinky sú uvedené v súhrne charakteristických vlastností lieku. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie : Neuchovávajte pri teplote nad 30°C. Chráňte pred mrazom.Uchovávajte v pôvodnom balení kvôli ochrane pred vlhkom. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Výdaj lieku je viazaný na lekársky predpis. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko Dátum poslednej aktualizácie SPC: 17.9.2018 Dátum vypracovania/poslednej aktualizácie reklamy:
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421(0)2 2060 2600.
▼ Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie.
Zloženie: NINLARO 2,3 mg tvrdé kapsuly. Každá kapsula obsahuje 2,3 mg ixazomibu (vo forme 3,3 mg ixazomíbiumcitrátu). NINLARO 3 mg tvrdé kapsuly. Každá kapsula obsahuje 3 mg ixazomibu (vo forme 4,3 mg ixazomíbiumcitrátu). NINLARO 4 mg tvrdé kapsuly. Každá kapsula obsahuje 4 mg ixazomibu (vo forme 5,7 mg ixazomíbiumcitrátu) Pomocné látky: pozrite v SPC Indikácie: NINLARO je v kombinácii s lenalidomidom a dexametazónom indikovaný na liečbu dospelých pacientov s mnohopočetným myelómom, ktorí dostali aspoň jednu predchádzajúcu liečbu. Dávkovanie a spôsob podávania: Odporúčaná úvodná dávka ixazomibu je 4 mg podávaná perorálne, jedenkrát týždenne v 1, 8. a 15. deň 28-dňového liečebného cyklu. Odporúčaná úvodná dávka lenalidomidu je 25 mg podávaná denne v 1. až 21. deň 28-dňového liečebného cyklu. Odporúčaná úvodná dávka dexametazónu je 40 mg podávaná v 1., 8., 15. a 22. deň 28-dňového liečebného cyklu. Pred začatím nového liečebného cyklu: absolútny počet neutrofilov má byť ≥ 1 000/mm3, počet trombocytov má byť ≥ 75 000/mm3, nehematologické toxicity majú byť podľa uváženia lekára späť na počiatočnom stave alebo ≤ 1. stupňa. V liečbe sa má pokračovať až do progresie ochorenia alebo výskytu neakceptovateľnej toxicity. V prípade oneskorenia alebo vynechania dávky ixazomibu sa má dávka užiť iba ak je ďalšia dávka plánovaná za ≥ 72 hodín. Vynechaná dávka sa nemá užiť v priebehu 72 hodín od ďalšej plánovanej dávky. Nemá sa užiť dvojnásobná dávka, aby sa nahradila vynechaná dávka. Ak pacient po užití dávky vracia, nemá užiť ďalšiu dávku, ale má pokračovať v dávkovaní v čase ďalšej plánovanej dávky. Úpravy dávky: Odporúčaná je znížená dávka 3 mg v prítomnosti stredného alebo ťažkého poškodenia pečene, ťažkého poškodenia obličiek alebo ochorenia obličiek v poslednom štádiu (End-Stage Renal Disease, ESRD) vyžadujúceho dialýzu. Striedanie úprav dávky sa odporúča pre ixazomib a lenalidomid pri prekrývajúcich sa toxicitách trombocytopénie, neutropénie a vyrážky. Pre tieto toxicity je prvým krokom úpravy dávky prerušenie/zníženie dávky lenalidomidu. Ohľadne krokov na zníženie dávky pre tieto toxicity si prečítajte SPC lenalidomidu. Súbežne podávané lieky :U pacientov liečených ixazomibom sa má zvážiť antivírusová prevencia na zníženie rizika reaktivácie herpesu zoster. U pacientov zahrnutých do štúdií s ixazomibom, ktorí dostávali antivírusovú prevenciu, bol výskyt infekcie herpesom zoster nižší v porovnaní s pacientmi, ktorí antivírusovú prevenciu nedostávali. Prevencia trombózy sa odporúča u pacientov liečených ixazomibomv kombinácii s lenalidomidom a dexametazónom a má sa zakladať na vyhodnotení existujúcich rizík a klinického stavu pacienta- Starší pacienti: Pre pacientov starších ako 65 rokov nie je potrebná žiadna úprava dávky ixazomibu. Poškodenie pečene :Nie je potrebná žiadna úprava dávky ixazomibu u pacientov s miernym poškodením pečene Poškodenie obličiek :U pacientov s ľahkým alebo stredným poškodením obličiek (klírens kreatinínu ≥ 30 ml/min) nie je potrebná žiadna úprava dávky ixazomibu. Znížená dávka 3 mg sa odporúča u pacientov s ťažkým poškodením obličiek (klírens kreatinínu < 30 ml/min) alebo s ochorením obličiek v poslednom štádiu (ESRD) vyžadujúcom dialýzu. Ixazomib sa neodstraňuje dialýzou a preto sa môže podávať bez ohľadu na načasovanie dialýzy. Kontraindikácie: Precitlivenosť na aktívnu látku alebo ktorúkoľvek z pomocných látok. Osobitné upozornenia a opatrenia pri používaní: Keďže sa ixazomib podáva v kombinácii s lenalidomidom a dexametazónom, prečítajte si ohľadne ďalších osobitných upozornení a opatrení pri používaní súhrn charakteristických vlastností týchto liekov. Pri liečbe liekom ixazomib sa hlásila trombocytopénia s minimálnymi hodnotami trombocytov vyskytujúcimi sa typicky medzi 14. – 21. dňom každého 28-dňového cyklu a navrátením hodnôt na počiatočnú hodnotu na začiatku ďalšieho cyklu. Pri liečbe liekom ixazomib sa hlásili hnačka, zápcha, nevoľnosť a vracanie, ktoré niekedy vyžadovali použitie antiemetík a liekov proti hnačke, ako aj podpornú liečbu . Pri ťažkých (3. – 4. stupeň) príznakoch sa má upraviť dávka. V prípade ťažkých gastrointestinálnych príhod sa odporúča sledovanie koncentrácií draslíka v sére. S ixazomibom sa hlásil výskyt periférnej neuropatie (pozri časť 4.8). U pacienta sa majú sledovať príznaky periférnej neuropatie. U pacientov, u ktorých sa vyskytne nový prípad periférnej neuropatie alebo u ktorých dôjde k jej zhoršeniu, môže byť potrebná úprava dávky. S ixazomibom sa hlásil výskyt periférneho edému (pozri časť 4.8). U pacienta sa majú vyhodnotiť základné príčiny a podľa potreby sa mu má poskytnúť podporná liečba. Dávka dexametazónu sa má upraviť podľa predpisovej informácie ixazomibu pre príznaky 3. alebo 4. stupňa ( s ixazomibom sa hlásil výskyt vyrážky (pozri časť 4.8). Vyrážka sa má liečiť podpornou starostlivosťou, alebo v prípade výskytu 2. alebo vyššieho stupňa, úpravou dávky. S ixazomibom sa menej často hlásil výskyt poškodenia pečene spôsobeného liekom, hepatocelulárneho poškodenia, steatózy pečene, cholestatickej hepatitídy a hepatotoxicity (pozri časť 4.8). Majú sa pravidelne sledovať pečeňové enzýmy a v prípade výskytu príznakov 3. alebo 4. stupňa sa má upraviť dávka. Ženy sa počas liečby ixazomibom musia vyhnúť otehotneniu. U pacientov dostávajúcich ixazomib sa vyskytol syndróm posteriórnej reverzibilnej encefalopatie (Posterior Reversible Encephalopathy Syndrome, PRES). U pacientov, u ktorých sa vyvinul PRES, sa má ukončiť liečba Ixazomibom . Silné induktory môžu znižovať účinnosť ixazomibu, preto sa treba vyhnúť súbežnému používaniu silných induktorov CYP3A ako sú karbamazepín, fenytoín, rifampicín a ľubovník bodkovaný (Hypericum perforatum). Liekové a iné interakcie: Inhibítory CYP :Súbežné podávanie ixazomibu s klaritromycínom, silným inhibítorom CYP3A, neviedlo ku klinicky významnej zmene systémovej expozície ixazomibu. Hodnota Cmax ixazomibu sa znížila o 4 % a hodnota AUC ixazomibu sa zvýšila o 11 %. Preto nie je pri súbežnom podávaní so silnými inhibítormi CYP3A potrebná žiadna úprava dávky ixazomibu. Induktory CYP :Súbežné podávanie ixazomibu s rifampicínom znížilo hodnotu Cmax ixazomibu o 54 % a hodnotu AUC ixazomibu o 74 %. Preto sa súbežné podávanie silných induktorov CYP3A s ixazomibom neodporúča. Ixazomib nie je reverzibilným ani časovo závislým inhibítorom CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 alebo 3A4/5. Ixazomib neindukoval aktivitu CYP1A2, CYP2B6 ani CYP3A4/5 ani zodpovedajúce hladiny imunoreaktívnych proteínov. Neočakávajú sa liekové interakcie ixazomibu prostredníctvom inhibície alebo indukcie CYP. Interakcie zakladajúce sa na transportéroch: Ixazomib je substrátom P-gp s nízkou afinitou. Ixazomib nie je substrátom BCRP, MRP2 ani pečeňových OATP. Ixazomib nie je inhibítorom P-gp, BCRP, MRP2, OATP1B1, OATP1B3, OCT2, OAT1, OAT3, MATE1 ani MATE2-K. Neočakávajú sa liekové interakcie ixazomibu sprostredkované transportérmi. Perorálna antikoncepcia: Pri súbežnom podávaní ixazomibu s dexametazónom, ktorý je známym slabým až stredným induktorom CYP3A4, ako aj iných enzýmov a transportérov, treba zvážiť riziko zníženej účinnosti perorálnej antikoncepcie. Ženy používajúce hormonálnu antikoncepciu majú dodatočne používať bariérovú antikoncepčnú metódu. Fertilita, gravidita,dojčenie: Keďže ixazomib sa podáva v kombinácii s lenalidomidom a dexametazónom, ohľadne ďalších informácií o fertilite, gravidite a dojčení si prečítajte súhrn charakteristických vlastností týchto liekov. Ženy vo fertilnom veku/antikoncepcia u mužov a žien :Muži aj ženy, ktorí sú schopní splodiť dieťa, musia používať účinné antikoncepčné metódy počas liečby a 90 dní po liečbe. Ixazomib sa neodporúča užívať u žien vo fertilnom veku nepoužívajúcich antikoncepciu. Pri súbežnom podávaní ixazomibu s dexametazónom, ktorý je známym slabým až stredným induktorom CYP3A4, ako aj iných enzýmov a transportérov, treba zvážiť riziko zníženej účinnosti perorálnej antikoncepcie. Preto majú ženy používajúce perorálnu hormonálnu antikoncepciu dodatočne používať bariérovú antikoncepčnú metódu. Fertilita:Štúdie fertility neboli s ixazomibom uskutočnené Gravidita: ixazomib sa neodporúča používať počas gravidity, pretože môže pri podávaní gravidným ženám spôsobiť poškodenie plodu. Preto sa majú ženy počas liečby ixazomibom vyhnúť otehotneniu. Nie sú k dispozícii údaje o použití ixazomibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu. Dojčenie :Nie je známe, či sa ixazomib alebo jeho metabolity vylučujú do ľudského mlieka. K dispozícii nie sú žiadne údaje získané u zvierat. Riziko u novorodencov/dojčiat nemôže byť vylúčené a preto má byť laktácia ukončená. Ixazomib sa podáva v kombinácii s lenalidomidom. Lenalidomid je štrukturálne príbuzný s talidomidom. Talidomid je známa teratogénne aktívna látka u ľudí, ktorá spôsobuje život ohrozujúce vrodené vady. Pri užívaní lenalidomidu počas tehotenstva sa u ľudí očakáva teratogénny účinok. Ak neexistuje spoľahlivý dôkaz o neplodnosti pacienta, podmienky programu na zabránenie otehotnenia pre lenalidomid sa musia dodržiavať u všetkých pacientov. Prečítajte si aktuálny súhrn charakteristických vlastností lieku. Nežiaduce účinky : Keďže sa ixazomib podáva v kombinácii s lenalidomidom a dexametazónom, prečítajte si ohľadne ďalších nežiaducich účinkov súhrn charakteristických vlastností týchto liekov. Veľmi časté: infekcie horných dýchacích ciest, trombocytopénia, neutropénia, periférna neuropatia, hnačka, nauzea, vracenie, zápcha, vyrážka, bolesť chrbáta, periférny edém. Časté: Herpes zoster. Ukončenie liečby: U každého nežiadúceho účinku došlo k ukončeniu liečby jedným nebo niekoľkými z troch liekov u ≤ 1 % pacientov v režime s ixazomibom. Trombocytopénia: U troch percent pacientov s režimom NINLARO a u 1 % pacientov v režime s placebom bol v priebehu liečby počet krvných doštičiek ≤ 10 000/mm3. Menej ako 1 % pacientov v oboch režimoch malo počas liečby počet krvných doštičiek ≤ 5 000/mm3. K ukončeniu liečby jedným nebo niekoľkými z troch liekov došlo pre trombocytopéniu u < 1 % pacientov v režime s ixazomibom a u 2 % pacientov v režime s placebom. Trombocytopénia neviedla k vzostupu hemoragických príhod ani transfúzii krvných doštičiek. Gastrointestinálna toxicita: Hnačka viedla k ukončeniu liečby jedným abo niekoľkými z troch liekov u 1 % pacientov v režime s NINLARO a u < 1 % pacientov v režime s placebom. Ostatné nežiaduce účinky sú uvedené v súhrne charakteristických vlastností lieku. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie : Neuchovávajte pri teplote nad 30°C. Chráňte pred mrazom.Uchovávajte v pôvodnom balení kvôli ochrane pred vlhkom. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Výdaj lieku je viazaný na lekársky predpis. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko Dátum poslednej aktualizácie SPC: 17.9.2018 Dátum vypracovania/poslednej aktualizácie reklamy:
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421(0)2 2060 2600.


