FEIBA NF – plazmatický proteín s aktivitou obchádzajúcou inhibítor koagulačného faktoraVIII (Factor Eight Inhibitor Bypassing Activity-FEIBA)1, 2
Terapeutické indikácie1, 2
FEIBA NF – plazmatický proteín s aktivitou obchádzajúcou inhibítor koagulačného faktoraVIII (Factor Eight Inhibitor Bypassing Activity-FEIBA)1, 2
Terapeutické indikácie1, 2
- Liečba a profylaxia krvácania u pacientov s hemofíliou A a prítomným inhibítorom faktora VIII.
- Liečba a profylaxia krvácania u pacientov s hemofíliou B a prítomným inhibítorom faktora IX.
- Liečba a profylaxia krvácania u nehemofilikov so získanými inhibítormi faktorov VIII, IX a XI.
- pri profylaxii, prevencia krvácania počas imunotolerančnej liečby (ITI), ak ITI nie je dostatočná alebo pacient k nej nemá prístup6
- pri liečbe podľa potreby, on-demand7
- pri kontrole krvácania počas chirurgických výkonov6, 7
- pri liečbe získanej hemofílie8
- pri domácej liečbe on demand s dobrou toleranciou (87 % pacientov)9
- kvôli relatívne dlhým (6- až 12-hodinovým) intervalom dávkovania1, 2
- Spontánne krvácanie
- Chirurgické zákroky
- Profylaxia
- Profylaxia krvácania u pacientov s vysokým titrom inhibítora a s častým krvácaním, u ktorých nebola úspešná imunotolerančná liečba („immune tolerance induction“, ITI) alebo sa o nej neuvažuje:
- Profylaxia krvácania u pacientov s vysokým titrom inhibítora, ktorí podstupujú ITI (imunotolerančnú liečbu):
Skrátená informácia o lieku
FEIBA NF 500 / 1000 prášok a rozpúšťadlo na injekčný alebo infúzny roztok. Terapeutické indikácie: Liečba a profylaxia krvácania u pacientov s hemofíliou A a prítomným inhibítorom faktora VIII. Liečba a profylaxia krvácania u pacientov s hemofíliou B a prítomným inhibítorom faktora IX. Liečba a profylaxia krvácania u nehemofilikov so získanými inhibítormi faktorov VIII, IX a XI. Kontraindikácie: Hypersenzivita na liečivú látku alebo na ktorúkoľvek zložku. Diseminovaná intravaskulárna koagulácia (DIK). Akútna trombóza alebo embólia (vrátane infarktu myokardu). Klinicky významné varovania: Pri prvých príznakoch alebo symptómoch trombotickej a tromboembolickej príhody sa musí podávanie infúzie okamžite ukončiť a musia sa zahájiť náležité diagnostické a liečebné opatrenia. U pacientov, ktorí pravidelne/opakovane dostávajú lieky pripravené z ľudskej plazmy, vrátane FIEBA NF, by sa malo zvážiť vhodné očkovanie (hepatitída A a B). Pacienti s poruchou funkcie pečene majú zvýšené riziko vzniku DIK vzhľadom na oneskorené odstraňovanie aktivovaných koagulačných faktorov. Klinicky významné upozornenia pre použitie: Rôzna odpoveď na „bypassing“ prípravky: Vzhľadom na faktory špecifické pre daného pacienta sa môže jeho odpoveď na „bypassový“ prípravok rôzniť a pri danom krvácavom stave môže pacient na jeden typ reagovať a na druhý nie. Ak nedostatočne odpovedá na jeden typ „bypassového“ prípravku, má sa zvážiť podanie iného. Anamnestické odpovede: Podávanie lieku FEIBA NF pacientom s inhibítormi môže vyvolať úvodný „anamnestický“ vzostup hladín inhibítora. S pokračujúcim podávaním FEIBA NF môže inhibítor po čase klesnúť. Klinické a publikované údaje naznačujú, že účinnosť FEIBA NF nie je znížená. Klinicky významné nežiaduce účinky a interakcie: FEIBA NF môže vyvolať reakcie z precitlivenosti alergického typu, ktoré zahŕňajú urtikáriu, angioedém, gastrointestinálne prejavy, bronchospamus a pokles tlaku krvi. Tieto reakcie môžu byť závažné a môžu byť systémové. Takisto boli hlásené ďalšie reakcie na infúziu ako triaška, pyrexia a hypertenzia. Z postregistračného sledovania boli hlásené reakcie ako bolesť hlavy, závrat, hypotenzia vyrážka a pozitivita protilátok proti povrchovému antigénu hepatitídy B. Neboli vykonané žiadne adekvátne a kontrolované štúdie s kombinovaným alebo sekvenčným podávaním FEIBA a rekombinantného faktora VIIa alebo antifibrinolytík. Pri súčasnom podávaní FEIBA NF spolu s antifibrinolytikami, napr. s kyselinou tranexámovou a aminokaprónovou je potrebné zvážiť možnosť zvýšeného rizika trombózy. Preto sa antifibrinolytiká nemajú podať skôr ako približne 6 až 12 hodín po podaní lieku FEIBA NF. Pri súčasnom podaní rFVIIa sa podľa dostupných údajov in vitro v a klinických pozorovaní môžu vyskytnúť potenciálne liekové interakcie (čo môže viesť k nežiaducim účinkom, ako sú trombotické príhody). Dostupné liekové formy: Injekčná liekovka s práškom a injekčná liekovka s 20 ml rozpúšťadla v balení s pomôckou BAXJECT II alebo s obojstrannou ihlou. Dávkovanie a spôsob podávania: Spontánne krvácanie: Všeobecne sa odporúča podávať 50 – 100 U/kg telesnej hmotnosti. Celková jednorazová dávka by nemala prekročiť 100 U/kg telesnej hmotnosti a maximálna denná dávka 200 U/kg telesnej hmotnosti, pokiaľ závažnosť krvácania neoprávňuje a neospravedlňuje použitie vyšších dávok. Chirurgické zákroky: Má sa podávať dávka 50 – 100 U/kg telesnej hmotnosti v 6-hodinových intervaloch, pričom sa nesmie prekročiť maximálna denná dávka. Profylaxia: Profylaxia krvácania u pacientov s vysokým titrom inhibítora a s častým krvácaním, u ktorých nebola úspešná ITI alebo sa o nej neuvažuje: 70 – 100 U/ kg telesnej hmotnosti každý druhý deň. Profylaxia krvácania u pacientov s vysokým titrom inhibítora, ktorí podstupujú ITI: súbežne s koncentrátmi faktora VIII, v rozmedzí dávky od 50 do 100 U/kg telesnej hmotnosti dvakrát denne, až kým nedôjde k poklesu inhibítora faktora VIII na < 2 BU. Skúsenosti s použitím lieku FEIBA NF u detí mladších ako 6 rokov sú obmedzené; pre klinické podmienky dieťaťa sa môže upraviť rovnaký dávkovací režim ako u dospelých. FEIBA NF sa musí podávať intravenózne ako injekcia alebo infúzia. Rýchlosť podávania nemá prekročiť 2 U/kg telesnej hmotnosti za minútu.
Dátum poslednej revízie textu: 01/2020. Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky http://www.ema.europa.eu/ . Registračné čísla a držiteľ rozhodnutia o registrácii: 16/0133/80-C/S, 16/0225/13-S, Baxalta Innovations GmbH, Industriestrasse 67, 1221 Viedeň, Rakúsko. Výdaj lieku je viazaný na lekársky predpis. Liek je uhrádzaný na základe verejného zdravotného poistenia. Pred predpísaním lieku si prosím prečítajte úplné znenie súhrnu charakteristických vlastností lieku. Dátum vypracovania reklamy: apríl 2020. Takeda Pharmaceuticals Slovakia s.r.o., Plynárenská 7B, 821 09 Bratislava, kancelária: Mýtna 48, 811 07 Bratislava, Slovenská republika, tel.: +421-2-2039 9300. Ak sa u vás vyskytne akýkoľvek vedľajší účinok môžete ho nahlásiť držiteľovi registrácie na drugsafety@shire.com a zároveň aj na neziaduce.ucinky@sukl.sk . Na podávanie hlásení podozrenia na nežiaduci účinok lieku slúži https://portal.sukl.sk/eskadra.
FEIBA NF 500 / 1000 prášok a rozpúšťadlo na injekčný alebo infúzny roztok. Terapeutické indikácie: Liečba a profylaxia krvácania u pacientov s hemofíliou A a prítomným inhibítorom faktora VIII. Liečba a profylaxia krvácania u pacientov s hemofíliou B a prítomným inhibítorom faktora IX. Liečba a profylaxia krvácania u nehemofilikov so získanými inhibítormi faktorov VIII, IX a XI. Kontraindikácie: Hypersenzivita na liečivú látku alebo na ktorúkoľvek zložku. Diseminovaná intravaskulárna koagulácia (DIK). Akútna trombóza alebo embólia (vrátane infarktu myokardu). Klinicky významné varovania: Pri prvých príznakoch alebo symptómoch trombotickej a tromboembolickej príhody sa musí podávanie infúzie okamžite ukončiť a musia sa zahájiť náležité diagnostické a liečebné opatrenia. U pacientov, ktorí pravidelne/opakovane dostávajú lieky pripravené z ľudskej plazmy, vrátane FIEBA NF, by sa malo zvážiť vhodné očkovanie (hepatitída A a B). Pacienti s poruchou funkcie pečene majú zvýšené riziko vzniku DIK vzhľadom na oneskorené odstraňovanie aktivovaných koagulačných faktorov. Klinicky významné upozornenia pre použitie: Rôzna odpoveď na „bypassing“ prípravky: Vzhľadom na faktory špecifické pre daného pacienta sa môže jeho odpoveď na „bypassový“ prípravok rôzniť a pri danom krvácavom stave môže pacient na jeden typ reagovať a na druhý nie. Ak nedostatočne odpovedá na jeden typ „bypassového“ prípravku, má sa zvážiť podanie iného. Anamnestické odpovede: Podávanie lieku FEIBA NF pacientom s inhibítormi môže vyvolať úvodný „anamnestický“ vzostup hladín inhibítora. S pokračujúcim podávaním FEIBA NF môže inhibítor po čase klesnúť. Klinické a publikované údaje naznačujú, že účinnosť FEIBA NF nie je znížená. Klinicky významné nežiaduce účinky a interakcie: FEIBA NF môže vyvolať reakcie z precitlivenosti alergického typu, ktoré zahŕňajú urtikáriu, angioedém, gastrointestinálne prejavy, bronchospamus a pokles tlaku krvi. Tieto reakcie môžu byť závažné a môžu byť systémové. Takisto boli hlásené ďalšie reakcie na infúziu ako triaška, pyrexia a hypertenzia. Z postregistračného sledovania boli hlásené reakcie ako bolesť hlavy, závrat, hypotenzia vyrážka a pozitivita protilátok proti povrchovému antigénu hepatitídy B. Neboli vykonané žiadne adekvátne a kontrolované štúdie s kombinovaným alebo sekvenčným podávaním FEIBA a rekombinantného faktora VIIa alebo antifibrinolytík. Pri súčasnom podávaní FEIBA NF spolu s antifibrinolytikami, napr. s kyselinou tranexámovou a aminokaprónovou je potrebné zvážiť možnosť zvýšeného rizika trombózy. Preto sa antifibrinolytiká nemajú podať skôr ako približne 6 až 12 hodín po podaní lieku FEIBA NF. Pri súčasnom podaní rFVIIa sa podľa dostupných údajov in vitro v a klinických pozorovaní môžu vyskytnúť potenciálne liekové interakcie (čo môže viesť k nežiaducim účinkom, ako sú trombotické príhody). Dostupné liekové formy: Injekčná liekovka s práškom a injekčná liekovka s 20 ml rozpúšťadla v balení s pomôckou BAXJECT II alebo s obojstrannou ihlou. Dávkovanie a spôsob podávania: Spontánne krvácanie: Všeobecne sa odporúča podávať 50 – 100 U/kg telesnej hmotnosti. Celková jednorazová dávka by nemala prekročiť 100 U/kg telesnej hmotnosti a maximálna denná dávka 200 U/kg telesnej hmotnosti, pokiaľ závažnosť krvácania neoprávňuje a neospravedlňuje použitie vyšších dávok. Chirurgické zákroky: Má sa podávať dávka 50 – 100 U/kg telesnej hmotnosti v 6-hodinových intervaloch, pričom sa nesmie prekročiť maximálna denná dávka. Profylaxia: Profylaxia krvácania u pacientov s vysokým titrom inhibítora a s častým krvácaním, u ktorých nebola úspešná ITI alebo sa o nej neuvažuje: 70 – 100 U/ kg telesnej hmotnosti každý druhý deň. Profylaxia krvácania u pacientov s vysokým titrom inhibítora, ktorí podstupujú ITI: súbežne s koncentrátmi faktora VIII, v rozmedzí dávky od 50 do 100 U/kg telesnej hmotnosti dvakrát denne, až kým nedôjde k poklesu inhibítora faktora VIII na < 2 BU. Skúsenosti s použitím lieku FEIBA NF u detí mladších ako 6 rokov sú obmedzené; pre klinické podmienky dieťaťa sa môže upraviť rovnaký dávkovací režim ako u dospelých. FEIBA NF sa musí podávať intravenózne ako injekcia alebo infúzia. Rýchlosť podávania nemá prekročiť 2 U/kg telesnej hmotnosti za minútu.
Dátum poslednej revízie textu: 01/2020. Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky http://www.ema.europa.eu/ . Registračné čísla a držiteľ rozhodnutia o registrácii: 16/0133/80-C/S, 16/0225/13-S, Baxalta Innovations GmbH, Industriestrasse 67, 1221 Viedeň, Rakúsko. Výdaj lieku je viazaný na lekársky predpis. Liek je uhrádzaný na základe verejného zdravotného poistenia. Pred predpísaním lieku si prosím prečítajte úplné znenie súhrnu charakteristických vlastností lieku. Dátum vypracovania reklamy: apríl 2020. Takeda Pharmaceuticals Slovakia s.r.o., Plynárenská 7B, 821 09 Bratislava, kancelária: Mýtna 48, 811 07 Bratislava, Slovenská republika, tel.: +421-2-2039 9300. Ak sa u vás vyskytne akýkoľvek vedľajší účinok môžete ho nahlásiť držiteľovi registrácie na drugsafety@shire.com a zároveň aj na neziaduce.ucinky@sukl.sk . Na podávanie hlásení podozrenia na nežiaduci účinok lieku slúži https://portal.sukl.sk/eskadra.
MUDr. Denisa Jankovičová, PhD.: Personalizovaná profylaktická liečba v manažmente pacienta s hemofíliou A – skúsenosti z klinckej praxe
Edukačný webinár TAKEDA – 24. 9. 2020 a 15. 10. 2020
Personalizovaná profylaktická liečba v manažmente pacienta s hemofíliou A – skúsenosti z klinickej praxe.
Autor: MUDr. Jaroslava Feketeová
Spoločnosť TAKEDA zorganizovala v dňoch 24.9.2020 a 15.10.2020 pre hematológov na Slovensku edukačný online webinár, ktorého obsahom bola prednáška MUDr. Denisy Jankovičovej, PhD. z Národného hemofilického centra a Kliniky hematológie a transfuziológie LFUK, SZU v Bratislave pod názvom Personalizovaná profylaktická liečba v manažmente pacienta s hemofíliou A – skúsenosti z klinickej praxe.
Ako povedala v úvode prezentácie MUDr. Jankovičová, cieľom stretnutia bola výmena skúseností z klinickej praxe medzi hematológmi, ktorí nastavujú pacientov s hemofíliou na profylaktickú liečbu, čo dnes označujeme termínom „personalizovaná profylaxia“.
Všetci lekári, ktorí sa starajú o pacientov s hemofíliou, vedia, že základnou klinickou manifestáciou ochorenia je krvácanie, pri ťažkej forme hemofílie je to spontánne krvácanie, predovšetkým do pohybového aparátu.
Hemofília je nevyliečiteľné ochorenie, avšak dobre liečiteľné. Liečbou je náhrada koagulačného faktora intravenózne, a to faktora VIII alebo IX.
Existujú 2 spôsoby podania koagulačného faktora, a to epizodické – pri krvácaní (tzv. „on demand“) alebo preventívne – buď pred záťažou alebo operáciou, k preventívnemu podaniu radíme aj profylaxiu. Profylaxia môže byť krátkodobá, kontinuálna (viac ako 45 týždňov v roku), primárna, sekundárna a terciárna.
Dávkovanie koncentrátu FVIII/IX vychádza z praktických skúseností a zohľadňuje stupeň deficitu faktora, typ, závažnosť a lokalizáciu krvácania alebo operácie, hmotnosť pacienta, typ produktu a jeho farmakokinetické vlastnosti (biologický polčas).
Ako zdôraznila MUDr. Jankovičová, profylaxia je dnes považovaná za zlatý štandard v liečbe pacientov s ťažkou hemofíliou, ako detských, tak dospelých. Pri začatí profylaxie je dôležité zodpovedať tieto otázky: kedy s profylaxiou začať, aký zvoliť typ koncentrátu FVIII/FIX a režim profylaktickej liečby. Špecifickou témou je tzv. terciárna profylaxia u pacientov predtým liečených „on demand“.
Na začiatku profylaxie nastavujeme pacientov na štandardný profylaktický režim podľa počtu IU/kg 2 – 3x týždenne (v detstve). V ďalšom priebehu života sa profylaktický režim mení podľa počtu krvácaní do pohybového aparátu za rok, neskôr k zmene profylaxie pristupujú individuálne požiadavky hemofilikov. V adolescentnom veku sa režimy profylaxie u jednotlivých pacientov väčšinou líšia.
Personalizovaná profylaxia je mnohostranná a vychádza z rôznych atribútov, ovplyvňuje ju nielen frekvencia krvácaní u pacienta a stav kĺbov, ale aj jeho fyzická aktivita a životný štýl, očakávania pacienta, vek, hmotnosť, prístup pacienta, adherencia k liečbe, žilový prístup a farmakokinetika. V minulosti boli hemofilici väčšinou invalidnými dôchodcami, dnes žijú hemofilici aktívny život porovnateľný so zdravými ľuďmi, v ktorom ich lekári podporujú. Fyzická aktivita pri hemofílii zlepšuje kvalitu života, pretože zlepšuje fyzickú kondíciu, flexibilitu kĺbov, svalovú silu, kostnú štruktúru a zlepšuje/zvyšuje sebavedomie. Zároveň fyzická aktivita znižuje hmotnosť, redukuje únavu a depresiu. S fyzickou aktivitou sa znižuje riziko spontánneho krvácania do kĺbov, znižuje sa riziko chorôb srdca, hrubého čreva a cukrovky 2. typu.
Pri profylaxii je pre pacientov kľúčový žilový prístup, pretože pri podávaní koncentrátu 2 – 3x týždenne od 1. – 2. roku života je to asi 150 venepunkcií za rok a takmer 5000 za 30 rokov života.
Ako uviedla MUDr. Jankovičová, u detí sa preferuje ako venózny prístup periférna žila a v Národnom hemofilickom centre majú skúsenosti aj s centrálnymi venóznymi katétrami, a to najmä v súvislosti s imunotolerančnou liečbou, pričom sa využívajú u pacientov port-a-cathy alebo externé tunelované centrálne venózne katétre (Hickman, Broviac). U dospelých sa taktiež preferuje periférny žilový prístup, avšak pri zlom žilovom prístupe poukázala MUDr. Jankovičová na dobré skúsenosti s periférne implantovanou centrálnou kanylou (PICC) u svojich 5 dospelých pacientov s hemofíliou.
MUDr. Jankovičová ďalej zdôraznila, že pri profylaxii je takisto dôležitá adherencia k liečbe, pričom v útlom detstve je adherencia k liečbe vysoká, neskôr, najmä v adolescencii sa znižuje.
Pri nastavení profylaxie u pacienta má nezastupiteľné postavenie farmakokinetika (PK), ktorá „mapuje“ osud liečiva od podania po vylúčenie a berie do úvahy individuálnu odpoveď pacienta na podaný liek. Biologický polčas je základným parametrom PK, informuje, za aký čas klesne koncentrácia liečiva z maximálne dosiahnutej koncentrácie na polovicuꓼ biologický polčas vykazuje inter- a intraindividuálne rozdiely.
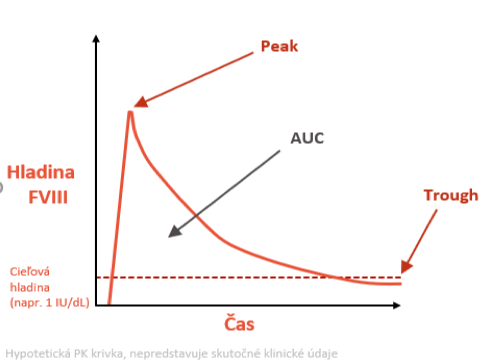
Ďalšími dôležitými parametrami pri sledovaní farmakokinetiky je FVIII peak – maximálna hladina po podaní a FVIII trough – minimálna hladina po podaní FVIII. Veľkosť plochy pod krivkou medzi peak a trough tzv. area under the FVIII level curve (AUC) je dôležitá pri prevencii klinických a subklinických krvácaní, čím vyšší je through, tým nižší je počet krvácaní (graf 1).
Graf 1: Farmakokinetika – parametre pri zostavovaní personalizovanej profylaxie
Farmakokinetika sa pre potreby individualizovanej profylaxie musí vyšetriť u každého pacienta, čo sa dnes uskutočňuje na základe populačných PK modelov na podklade tzv. Bayesovho odhadu, pričom stačí odobrať 1 – 3 vzorky bez wash-out periódy. Vieme stanoviť individuálnu PK krivku v 2 typoch dostupných programov : MyPKFit (program dimenzovaný pre produkty spoločnosti Takeda) a WAPPS Hemo (stanovenie PK pre všetky produkty).
MUDr. Jankovičová uviedla na klinickom príklade 3 možnosti na stanovenie individuálneho PK profilu a dávky u pacienta s HA v liečbe rekombinantným prípravkom pomocou programu MyPKFit, odobraté boli 2 vzorky, 3 a 24 hodín po podaní. Pacient mal dobrý biologický polčas FVIII 13,7 hodín a nízky klírens 2,8 ml/kg/hod. Ak sa v programe zvolil trough na úrovni 2% a podávanie FVIII u pacienta bolo nastavené na každých 48 hodín, v programe bola určená dávka 1 500 IU v režime každý druhý deň , pri tejto dávke by mal pacient hladinu FVIII nad 12% 13-15 hodín po podaní. Ak by sa zvolil trough na úrovni 1%, postačí u pacienta dávka 780 IU v režime každý druhý deň , avšak pri danom biologickom polčase pacienta sa uňho dosiahne peak FVIII iba 18%, čo nie je postačujúce pre fyzickú aktivitu. Treťou možnosťou v programe bolo nastavenie trough na úroveň 1% a podávanie á 72 hodín, v tomto prípade bola dávka určená na 2 500 IU v režime á 3 dni, pričom hladinu FVIII nad 12% by mal pacient 23 hodín po podaní.
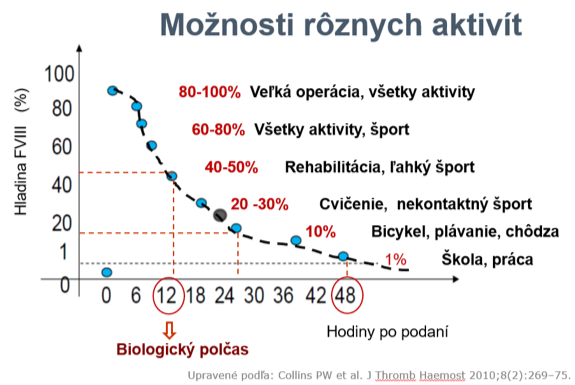
Pri stanovení krivky pre farmakokinetiku je potrebné si uvedomiť, že trough FVIII nad 1% chráni pacienta pred spontánnym krvácaním, nad 3% pred krvácaním do kĺbov a nad 12% by pacient nemal krvácať. Ak poznáme PK krivku, pacient sa môže venovať športovým aktivitám najmä po podaní profylaxie (graf 2).
Graf 2: Možnosti športových aktivít v závislosti od hladiny FVIII
MUDr. Jankovičová sa ďalej venovala prehľadu koncentrátov FVIII s predĺženým biologickým polčasom, ako uviedla, EHL-rFVIII spoločností Takeda a Sobi majú predĺžený biologický polčas 1,4 – 1,6 – násobne,. Pri EHL-rFVIII/FIX je dôležité poznať farmakokinetiku a uvedomiť si, čo chceme EHL-produktom dosiahnuť – či redukciu počtu podaní faktora, alebo v prípade, ak má pacient prelomové krvácania, potrebujeme zvýšiť trough. Redukcia počtu podaní má zmysel pre redukciu počtu venepunkcií u pacienta, aj pre zníženie ročnej spotreby prípravku.
V závere prezentácie MUDr. Jankovičová, PhD. zhrnula praktické aspekty manažmentu profylaktického režimu. Pri nastavovaní personalizovanej profylaxie je dôležitý pohovor s pacientom, monitoring hladín peak/trough, stanovenie inhibítora a farmakokinetiky (najmä pri EHL-rFVIII/FIX), vyšetrenie žilového systému a pochopenie princípu profylaxie pacientom. V priebehu profylaxie je nutné monitorovať minimálne hladiny, peaky, počty krvácaní za rok, zmenu životného štýlu, a to minimálne á 6 mesiacov.
Po prezentáciách pokračovala diskusia, v ktorej si kolegovia počas oboch workshopov vymenili aktuálne informácie o pacientoch s hemofíliou, ktorých starostlivosť zdieľajú s MUDr. Jankovičovou a Národným hemofilickým centrom.
V diskusii sme si potvrdili fakt, že pri liečbe s ohľadom na farmakokinetiku, sa pozoroval signifikantný rozdiel v odporúčanej dávke podľa veku, u menších detí sú potrebné vyššie dávky ako u detí vo veku nad 10 rokov.
Časť diskusie sa venovala aj téme personalizovanej profylaxie u športovcov a určitých limitov tejto profylaxie pri jednotlivých športoch, najmä pri kontaktných a vrcholových.
Diskusia pokračovala otázkami k zavádzaniu port-a-cathov. MUDr. Jankovičová spomenula vlastné skúsenosti s port-a-cathmi najmä pri podávaní imunotolerančnej liečby, uviedla ich výhody, aj limitácie, vrátane infekčných komplikácií, pri profylaktickej liečbe existujú aj dobré skúsenosti so zavedením PICC, a to aj pri terciárnej profylaxii u pacientov, ktorí boli predtým liečení on demand.
Ďalšia praktická otázka sa týkala vyšetrenia a transportu inhibítora, či vzorka krvi sa môže zamraziť a následne odoslať, odpoveď bola, že to je možné, vrátane odoslania do Národného hemofilického centra. Inhibítor je nutné vyšetrovať po 5.,10. a 20. expozičnej dávke faktora.
Posledná otázka v diskusii zaznela na tému používania mobilných aplikácií u adolescentov a mladých dospelých, podľa názoru MUDr. Jankovičovej, PhD. mobilné aplikácie zatiaľ neužíva vysoký počet adolescentov.
MUDr. Jaroslava Feketeová
VV-MEDMAT-29210
Morbus Gaucher
MUDr. Anna Hlavatá, PhD., MPH, MUDr. Katarína Juríčková Detská klinika LF UK a NÚDCH, Centrum dedičných metabolických porúch, Bratislava
[pdf-embedder url="https://takeda4health.sk/wp-content/uploads/2021/02/2020_Hlavata_Morbus-Gaucher.pdf" title="Morbus Gaucher"]
Kliknite TU pre stiahnutie PDF.
PS IBD ČR: Kontraindikace pro systémovou anti-TNFa biologickou léčbu v IBD
ENTYVIO® 300 MG PRÁŠOK NA PRÍPRAVU INFÚZNEHO KONCENTRÁTU - VEDOLIZUMAB
Skrátená informácia o lieku
Názov lieku: Entyvio 300 mg prášok na prípravu infúzneho koncentrátu. Zloženie: Každá injekčná liekovka obsahuje 300 mg vedolizumabu. Po rekonštitúcii obsahuje každý mililiter 60 mg vedolizumabu. Úplný zoznam pomocných látok pozrite v SPC. Indikácie: Liečba stredne ťažkej až ťažkej formy aktívnej ulceróznej kolitídy alebo stredne ťažkej až ťažkej formy aktívnej Crohnovej choroby u dospelých pacientov, ktorí mali na konvenčnú liečbu alebo na liečbu antagonistom tumor nekrotizujúceho faktoru alfa (tumour necrosis factor alpha, TNF α) neprimeranú odpoveď,,alebo u ktorých došlo k strate odpovede, alebo ktorí neznášali takúto liečbu. Dávkovanie a spôsob podávania: Odporúčaný dávkovací režim Entyvia je 300 mg podaného intravenóznou infúziou v nultý, druhý a šiesty týždeň a potom každých osem týždňov. Ulcerózna kolitída: Liečba u pacientov s ulceróznou kolitídou sa má ukončiť, ak sa do 10. týždňa nepozorovali žiadne dôkazy prínosu liečby. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Crohnova choroba: Dávka v 10. týždni môže byť prínosom pre pacientov s Crohnovou chorobou, u ktorých nebola pozorovaná odpoveď. V liečbe reagujúcich pacientov sa má pokračovať každých osem týždňov, počnúc 14. týždňom. Ak sa do 14. týždňa nepozorovali žiadne dôkazy prínosu liečby, liečba pacientov s Crohnovou chorobou sa má ukončiť. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Ak sa liečba preruší a je potrebné liečbu obnoviť, je možné zvážiť dávkovanie každé štyri týždne. Bezpečnosť a účinnosť vedolizumabu u detí vo veku od 0 do 17 rokov neboli doteraz stanovené. U starších pacientov nie je potrebné upraviť dávkovanie. Entyvio je určené len na intravenózne použitie ako intravenózna infúzia po dobu 30 minút. Pred podaním sa má rekonštituovať a ďalej nariediť (pozrite v SPC). Kontraindikácie: Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Aktívne závažné infekcie, ako sú tuberkulóza (TBC), sepsa, cytomegalovírusová infekcia, listerióza, a oportúnne infekcie, ako je progresívna multifokálna leukoencefalopatia (PML). Osobitné upozornenia a opatrenia pri používaní: Všetci pacienti musia byť nepretržite sledovaní počas každej infúzie a tiež po dobu približne jednej hodiny (dvoch hodín počas prvých dvoch infuzií) po ukončení infúzie. Boli hlásené reakcie súvisiace s podaním infúzie (infusion-related reactions, IRR) a príznaky precitlivenosti. Existuje možné zvýšené riziko oportúnnych infekcií alebo infekcií, pre ktoré je črevo ochrannou bariérou. Pred začiatkom liečby pacienti musia byť vyšetrení na tuberkulózu. Ak existuje podozrenie na PML, liečba sa musí pozastaviť; ak sa podozrenie potvrdí, liečba sa musí natrvalo ukončiť. Neodporúča sa súbežné používanie vedolizumabu s biologickými imunosupresívami. Pacienti liečení vedolizumabom môžu pokračovať v liečbe neživými vakcínami. Chrípková vakcína sa má podávať injekčne, v súlade s rutinnou klinickou praxou. Ostatné živé vakcíny sa môžu podávať súbežne s vedolizumabom len vtedy, ak ich prínos výrazne prevažuje nad rizikom. Vedolizumab podávaný pacientom, ktorí nie sú súbežne liečení kortikosteroidmi, môže byť menej účinný pre vznik remisie Crohnovej choroby v porovnaní s pacientmi, ktorí už súbežne dostávali kortikosteroidy. Liekové a iné interakcie: Súbežné podávanie kortikosteroidov, imunomodulátorov a aminosalicylátov nemalo klinicky významný vplyv na farmakokinetiku vedolizumabu. Živé vakcíny, najmä živé perorálne vakcíny, je potrebné používať opatrne, ak sa súbežne s nimi podáva Entyvio. Fertilita, gravidita a laktácia: Ženy vo fertilnom veku majú používať primeranú antikoncepciu na zabránenie gravidity a pokračovať v jej používaní aspoň počas 18 týždňov od poslednej liečby. Ako preventívne opatrenie sa odporúča vyhnúť sa používaniu Entyvia počas gravidity, ak prínos jasne neprevažuje nad akýmkoľvek možným rizikom pre matku aj plod. Účinok vedolizumabu na dojčatá nie je známy. Pri používaní vedolizumabu u dojčiacich žien sa má zvážiť prínos liečby pre matku a možné riziko pre dojča. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje: Entyvio môže mať malý vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje, keďže u malého počtu pacientov boli hlásené závraty. Nežiaduce účinky: Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (ako napríklad nazofaryngitída, infekcia horných dýchacích ciest, bronchitída, chrípka a sinusitída), bolesť hlavy, nauzea, horúčka, únava, kašeľ, bolesť kĺbov. Reakcie súvisiace s podaním infúzie boli hlásené u 4 % pacientov. V štúdiách boli hlásené závažné infekcie, ktoré zahrňujú tuberkulózu, sepsu (niektoré smrteľné), salmonelovú sepsu, listériovú meningitídu a cytomegalovírusovú kolitídu. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie: Uchovávajte v chladničke (2 °C – 8 °C). Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom. Rekonštituovaný alebo nariedený roztok nezuchovávajte v mrazničke. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Liek je viazaný na lekársky predpis s obmedzením predpisovania. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Dátum poslednej aktualizácie SPC: 20.2.2019. Dátum vypracovania/poslednej aktualizácie reklamy: október 2019.
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421220602600.
Názov lieku: Entyvio 300 mg prášok na prípravu infúzneho koncentrátu. Zloženie: Každá injekčná liekovka obsahuje 300 mg vedolizumabu. Po rekonštitúcii obsahuje každý mililiter 60 mg vedolizumabu. Úplný zoznam pomocných látok pozrite v SPC. Indikácie: Liečba stredne ťažkej až ťažkej formy aktívnej ulceróznej kolitídy alebo stredne ťažkej až ťažkej formy aktívnej Crohnovej choroby u dospelých pacientov, ktorí mali na konvenčnú liečbu alebo na liečbu antagonistom tumor nekrotizujúceho faktoru alfa (tumour necrosis factor alpha, TNF α) neprimeranú odpoveď,,alebo u ktorých došlo k strate odpovede, alebo ktorí neznášali takúto liečbu. Dávkovanie a spôsob podávania: Odporúčaný dávkovací režim Entyvia je 300 mg podaného intravenóznou infúziou v nultý, druhý a šiesty týždeň a potom každých osem týždňov. Ulcerózna kolitída: Liečba u pacientov s ulceróznou kolitídou sa má ukončiť, ak sa do 10. týždňa nepozorovali žiadne dôkazy prínosu liečby. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Crohnova choroba: Dávka v 10. týždni môže byť prínosom pre pacientov s Crohnovou chorobou, u ktorých nebola pozorovaná odpoveď. V liečbe reagujúcich pacientov sa má pokračovať každých osem týždňov, počnúc 14. týždňom. Ak sa do 14. týždňa nepozorovali žiadne dôkazy prínosu liečby, liečba pacientov s Crohnovou chorobou sa má ukončiť. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Ak sa liečba preruší a je potrebné liečbu obnoviť, je možné zvážiť dávkovanie každé štyri týždne. Bezpečnosť a účinnosť vedolizumabu u detí vo veku od 0 do 17 rokov neboli doteraz stanovené. U starších pacientov nie je potrebné upraviť dávkovanie. Entyvio je určené len na intravenózne použitie ako intravenózna infúzia po dobu 30 minút. Pred podaním sa má rekonštituovať a ďalej nariediť (pozrite v SPC). Kontraindikácie: Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Aktívne závažné infekcie, ako sú tuberkulóza (TBC), sepsa, cytomegalovírusová infekcia, listerióza, a oportúnne infekcie, ako je progresívna multifokálna leukoencefalopatia (PML). Osobitné upozornenia a opatrenia pri používaní: Všetci pacienti musia byť nepretržite sledovaní počas každej infúzie a tiež po dobu približne jednej hodiny (dvoch hodín počas prvých dvoch infuzií) po ukončení infúzie. Boli hlásené reakcie súvisiace s podaním infúzie (infusion-related reactions, IRR) a príznaky precitlivenosti. Existuje možné zvýšené riziko oportúnnych infekcií alebo infekcií, pre ktoré je črevo ochrannou bariérou. Pred začiatkom liečby pacienti musia byť vyšetrení na tuberkulózu. Ak existuje podozrenie na PML, liečba sa musí pozastaviť; ak sa podozrenie potvrdí, liečba sa musí natrvalo ukončiť. Neodporúča sa súbežné používanie vedolizumabu s biologickými imunosupresívami. Pacienti liečení vedolizumabom môžu pokračovať v liečbe neživými vakcínami. Chrípková vakcína sa má podávať injekčne, v súlade s rutinnou klinickou praxou. Ostatné živé vakcíny sa môžu podávať súbežne s vedolizumabom len vtedy, ak ich prínos výrazne prevažuje nad rizikom. Vedolizumab podávaný pacientom, ktorí nie sú súbežne liečení kortikosteroidmi, môže byť menej účinný pre vznik remisie Crohnovej choroby v porovnaní s pacientmi, ktorí už súbežne dostávali kortikosteroidy. Liekové a iné interakcie: Súbežné podávanie kortikosteroidov, imunomodulátorov a aminosalicylátov nemalo klinicky významný vplyv na farmakokinetiku vedolizumabu. Živé vakcíny, najmä živé perorálne vakcíny, je potrebné používať opatrne, ak sa súbežne s nimi podáva Entyvio. Fertilita, gravidita a laktácia: Ženy vo fertilnom veku majú používať primeranú antikoncepciu na zabránenie gravidity a pokračovať v jej používaní aspoň počas 18 týždňov od poslednej liečby. Ako preventívne opatrenie sa odporúča vyhnúť sa používaniu Entyvia počas gravidity, ak prínos jasne neprevažuje nad akýmkoľvek možným rizikom pre matku aj plod. Účinok vedolizumabu na dojčatá nie je známy. Pri používaní vedolizumabu u dojčiacich žien sa má zvážiť prínos liečby pre matku a možné riziko pre dojča. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje: Entyvio môže mať malý vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje, keďže u malého počtu pacientov boli hlásené závraty. Nežiaduce účinky: Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (ako napríklad nazofaryngitída, infekcia horných dýchacích ciest, bronchitída, chrípka a sinusitída), bolesť hlavy, nauzea, horúčka, únava, kašeľ, bolesť kĺbov. Reakcie súvisiace s podaním infúzie boli hlásené u 4 % pacientov. V štúdiách boli hlásené závažné infekcie, ktoré zahrňujú tuberkulózu, sepsu (niektoré smrteľné), salmonelovú sepsu, listériovú meningitídu a cytomegalovírusovú kolitídu. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie: Uchovávajte v chladničke (2 °C – 8 °C). Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom. Rekonštituovaný alebo nariedený roztok nezuchovávajte v mrazničke. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Liek je viazaný na lekársky predpis s obmedzením predpisovania. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Dátum poslednej aktualizácie SPC: 20.2.2019. Dátum vypracovania/poslednej aktualizácie reklamy: október 2019.
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421220602600.
Primárny a sekundárny imunodeficit
 |
KIOVIG je normálny ľudský imunoglobulín (vyrobený z plazmy ľudských darcov) s koncentráciou 10% určený na intravenózne podanie. Indikuje sa na substitučnú aj imunomodulačnú liečbu u dospelých, detí a dospievajúcich. |
 |
Cuvitru je normálny ľudský imunoglobulín (vyrobený z plazmy ľudských darcov) s koncentráciou 20% určený na subkutánne podanie. Indikuje sa na substitučnú liečbu u dospelých, detí a dospievajúcich s primárnou alebo sekundárnou imunodeficienciou. Substitučná liečba sa má začať pod dohľadom lekára, ďalej môže prebiehať v domácom prostredí. |
 |
HyQvia je normálny ľudský imunoglobulín s koncentráciou 10% určený na facilitované subkutánne podanie. Indikuje sa na substitučnú liečbu u dospelých, detí a dospievajúcich s primárnou alebo sekundárnou imunodeficienciou. Balenie sa skladá z dvoch liekoviek, jedna obsahuje imunoglobulín, druhá enzým rekombinantnú ľudskú hyaluronidázu. Infúzia enzýmu vytvorí priestor v podkožnom tkanive, čo umožňuje podávať subkutánne väčší objem imunoglobulínu a znížiť frekvenciu aplikácie. Substitučná liečba sa má začať pod dohľadom lekára, ďalej môže prebiehať v domácom prostredí. |
Primárny a sekundárny imunodeficit
 |
Firazyr je prvý liek na symptomatickú liečbu akútnych záchvatov hereditárneho (dedičného) angioedému aplikovaný subkutánne. Účinkuje ako selektívny kompetitívny antagonista B2 receptorov bradykinínu. Indikuje sa u dospelých, dospievajúcich a detí vo veku 2 roky a starších. Je určený na použitie pod dohľadom odborníka v oblasti zdravotnej starostlivosti s možnosťou domácej liečby, čo môže skrátiť čas podania od prvých príznakov záchvatu. |
 |
TAKHZYRO je plne humánna monoklonálna protilátka produkovaná vo vaječníkových bunkách čínskeho škrečka. Používa sa na rutinnú prevenciu záchvatov hereditárneho angioedému u pacientov vo veku 12 a viac rokov. Účinkuje ako špecifický inhibítor aktívneho plazmatického kalikreínu. Vďaka eliminačnému polčasu cca 14 dní umožňuje schému podávnia raz za dva týždne. Liečba sa má začať pod dohľadom lekára, potom sa môže aplikovať doma. |