SÚČASNÉ LIEČEBNÉ STRATÉGIE ZAMERANÉ NA OVPLYVNENIE PROGRESIE CROHNOVEJ CHOROBY – ECCO 2021
Autor: MUDr. Barbora Norek, PhD.
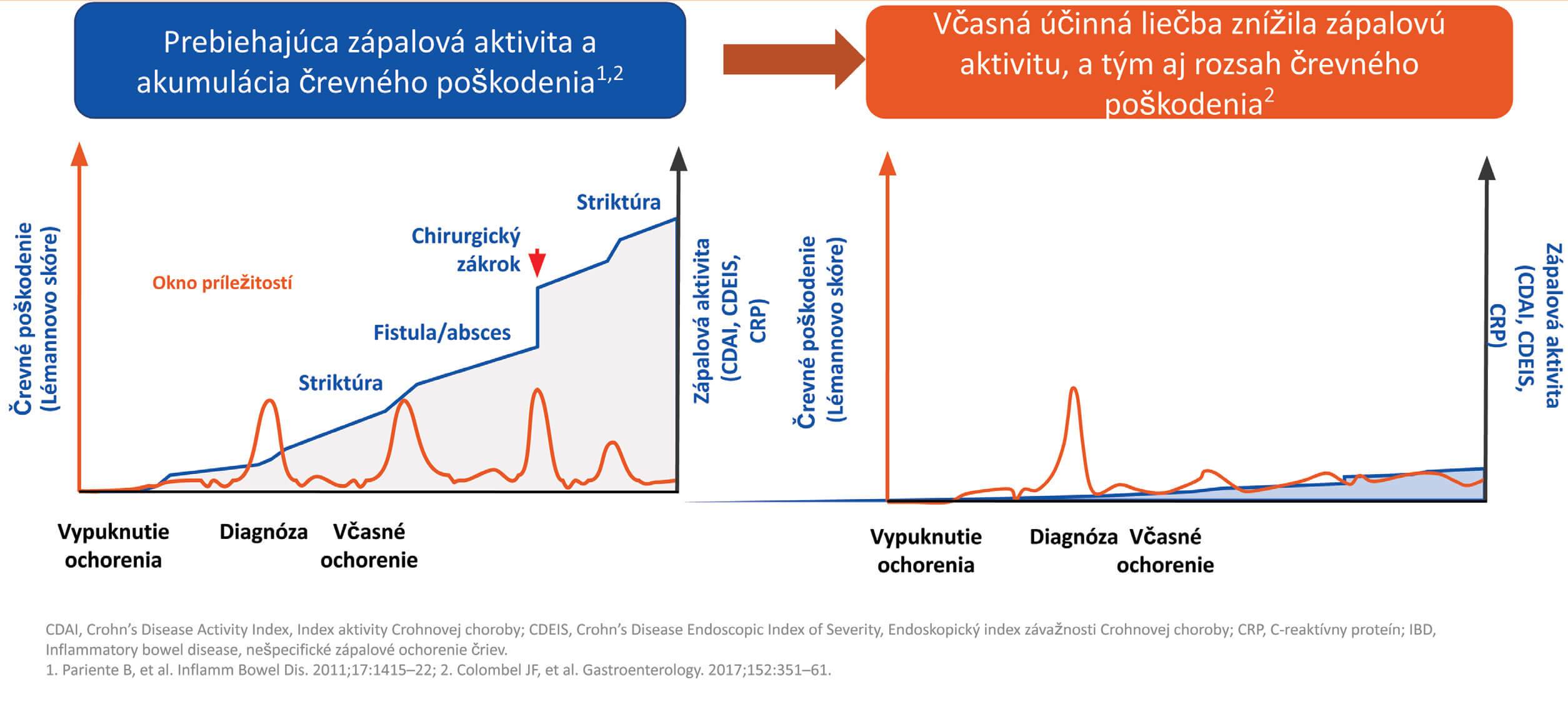
Sympózium bolo zamerané na to, ako možno správne a včas zvolenou liečbou ovplyvniť priebeh Crohnovej choroby (CD) v zmysle zníženia rizika vzniku penetrujúcich komplikácií, tvorby striktúr a potreby chirurgickej intervencie.(1,2) (Obr. 1) Dôraz sa kladie na včasnú liečbu imunomodulátormi a biologickú liečbu. Vieme nimi výrazne spomaliť až zastaviť progresiu CD a znížiť tak riziko vzniku možných komplikácií v porovnaní s pomalším „step up“ prístupom. (3) Najvýraznejší prelom v tejto oblasti znamená práve liečba anti-TNF alfa. AGA odporúča u dospelých pacientov so stredne ťažkou až ťažkou CD včasné zahájenie biologickej liečby s imunosupresívami alebo bez nich, a to bez čakania na zlyhanie 5-ASA a/alebo kortikoidov.(4) V súvislosti so snahou čo najlepšie a najefektívnejšie ovplyvniť priebeh CD vyvstávajú 2 hlavné otázky.
- Vieme identifikovať tých pacientov, ktorí majú vysoké riziko nepriaznivého priebehu CD? A ak áno:
- Dokážeme ovplyvniť progresiu CD u tejto vysokorizikovej skupiny pacientov, ak u nich budeme postupovať tzv. treat to target (T2T) spôsobom?
V úvode stanovenia diagnózy CD je potrebné stratifikovať riziko nepriaznivého priebehu CD. Existujú určité klinické ukazovatele ako napr. nízky vek nástupu ochorenia, postihnutie hornej časti GIT, stupeň endoskopickej aktivity a fenotyp ochorenia (napr. extraintestinálna manifestácia ochorenia), ktoré sú v čase stanovenia diagnózy považované za ukazovatele nepriaznivého priebehu CD. Okrem klinických ukazovateľov máme aj laboratórne prognostické faktory, ako napr. hladinu CRP, ASCA protilátky a genetické markery ako NOD 2.(5) Na webe je dostupný tzv. PROSPECT model, čo je nástroj na výpočet individuálneho rizika rozvoja komplikácií CD u dospelých pacientov v priebehu 3 rokov, založený na vyhodnotení klinických, sérologických a genetických markerov. Bol vytvorený za účelom pomôcť vybrať vhodný terapeutický postup u jednotlivého pacienta, ktorému bola diagnostikovaná CD a je zatiaľ bez komplikácií.(6)
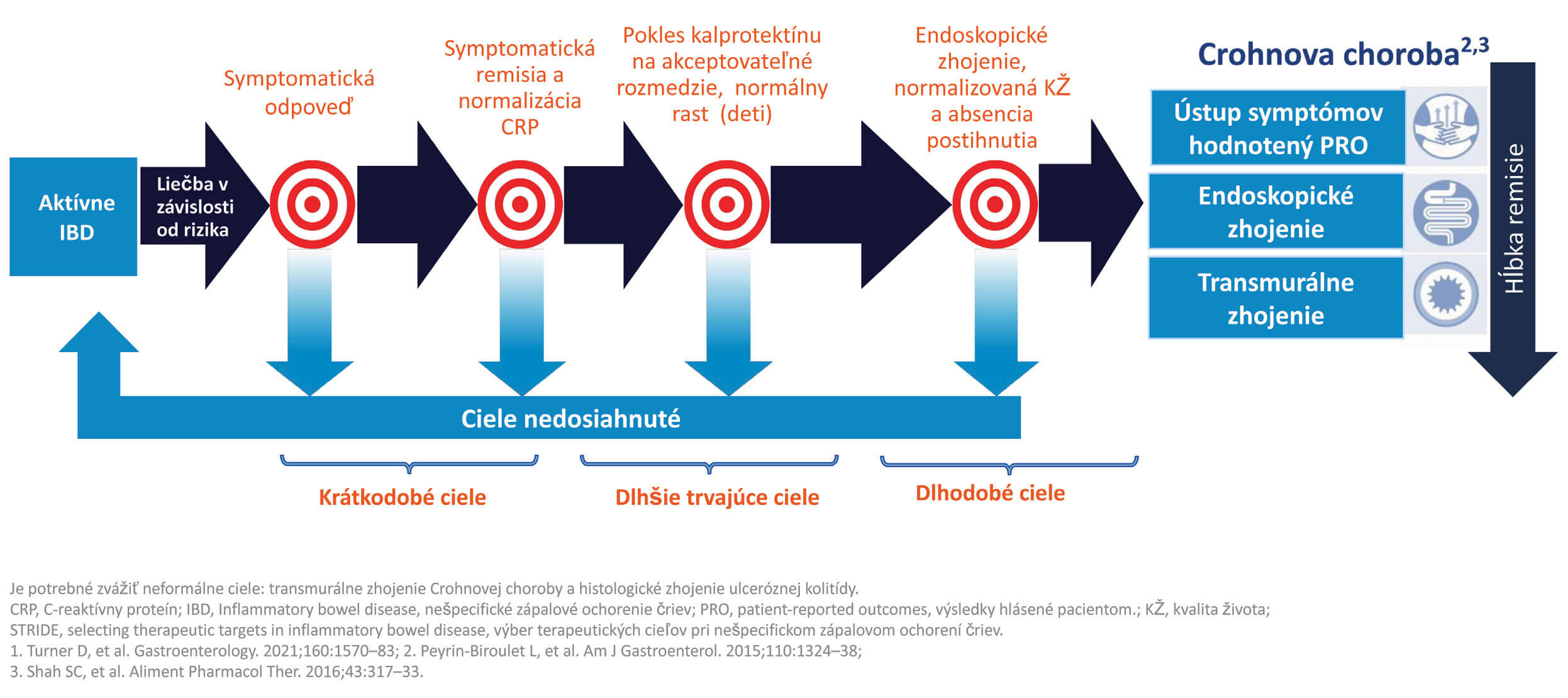
Liečebný prístup „treat to target (T2T)“ u pacientov s IBD zahŕňa stanovenie konkrétnych cieľov, na základe ktorých sa optimalizuje liečba a súčasne prísny monitoring špecifických a objektívnych markerov zápalu za účelom zlepšenia dlhodobých vyhliadok pacienta. Využíva individuálny prístup ku každému pacientovi na včasné zahájenie potrebnej liečby s cieľom spomaliť progresiu ochorenia, zabezpečiť prevenciu poškodenia čreva, potencovať slizničné hojenie a redukovať potrebu chirurgickej intervencie.(7,8) (Obr. 2)
Stále častejšie je zdôrazňovaná potreba stratifikácie rizika vývoja komplikácií u pacientov s CD, aby sa vyselektovali vysokorizikoví pacienti, u ktorých má význam včasné zahájenie biologickej liečby za účelom liečby tak samotného zápalu, ako aj zlepšenia klinického priebehu a prevencie dlhodobých komplikácií. Meta-analýza 11 štúdií, ktorá zahŕňala 2 501 pacientov ukázala, že zahájenie liečby anti-TNF alfa do troch rokov od stanovenia diagnózy redukuje potrebu chirurgickej intervencie a spomaľuje progresiu ochorenia v porovnaní s konvenčnou liečbou alebo neskoršou intervenciou.(9) Záverom inej prospektívnej štúdie so 130 pacientmi s CD, u ktorých sa hodnotil Lémannov index a IBD Disability Index bolo, že zahájenie liečby anti-TNF alfa do dvoch rokov od stanovenia diagnózy výrazne zmenšuje rozsah poškodenia čreva v porovnaní s neskoršou intervenciou.(10) Včasne zahájenou liečbou anti-TNF alfa môžeme taktiež do určitej miery ovplyvniť aj priebeh komplikácií ochorenia.(11)
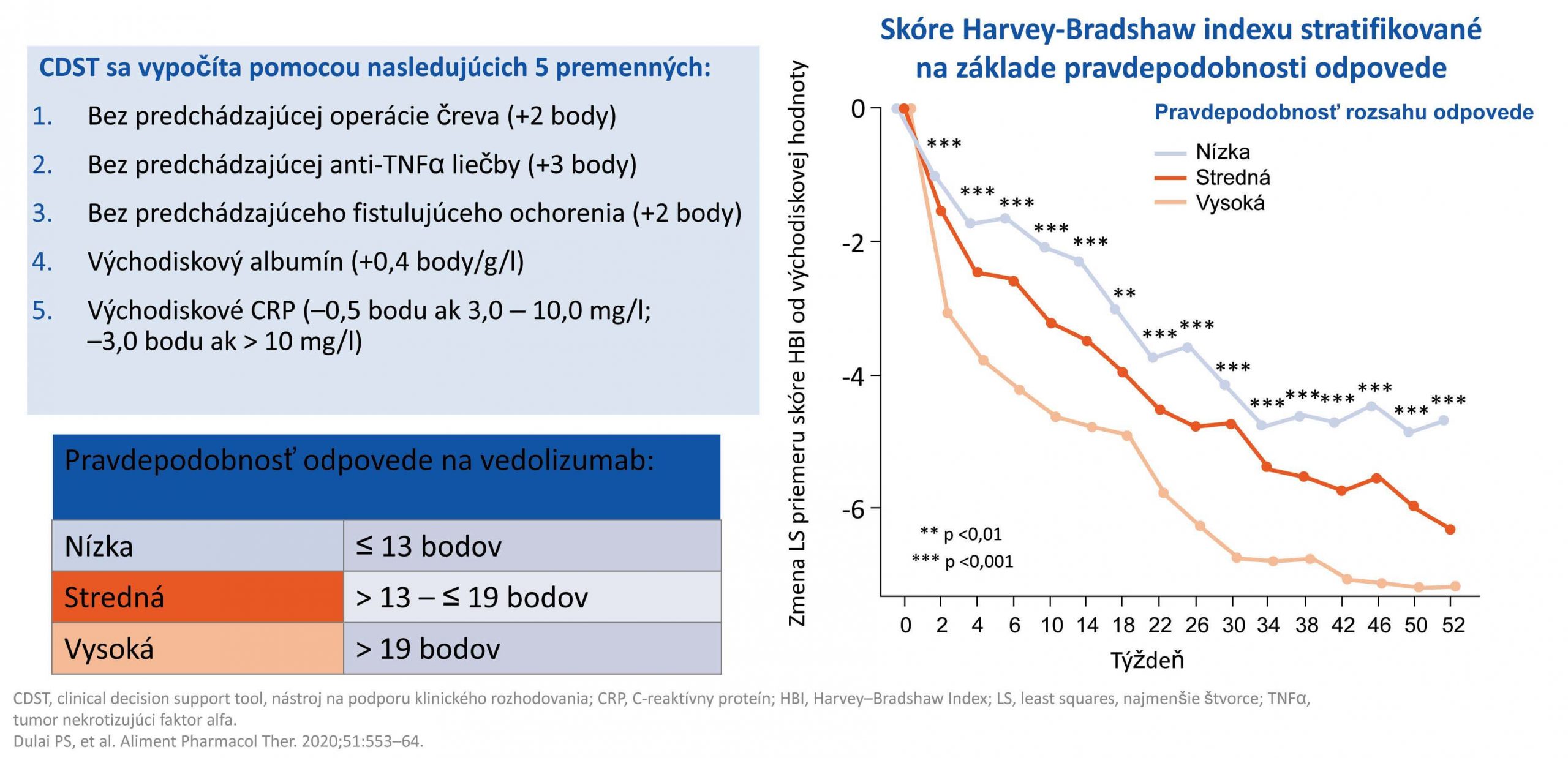
Na optimalizáciu liečby vedolizumabom bol vytvorený CDST index (clinical decision support tool), ktorý predikuje pravdepodobnosť efektu liečby vedolizumabom u konktrétneho pacienta. Do úvahy berie predchádzajúce chirurgické intervencie, predchádzajúcu liečbu anti-TNF alfa, fistulujúcu formu ochorenia, aktuálnu hladinu albumínu a CRP.(12) (Obr. 3) Pri porovnaní efektu liečby vedolizumabom v súvislosti s dĺžkou trvania ochorenia dosiahlo vyššie percento pacientov klinickú remisiu a slizničné hojenie pri kratšom trvaní ochorenia, teda pri včasnom zahájení liečby vedolizumabom. (13) V registri konzorcia VICTORY bol porovnávaný efekt vedolizumabu a liečby anti-TNF alfa v súvislosti s dĺžkou trvania ochorenia. Efekt vedolizumabu na dosiahnutie klinickej a endoskopickej remisie sa ukázal výrazný u pacientov, u ktorých ochorenie trvalo menej ako dva roky.(14) V štúdii EVOLVE dosiahli klinické zlepšenie biologicky naivní pacienti s nekomplikovaným priebehom CD liečení vedolizumabom v porovnaní s pacientmi s komplikáciami CD a po predchádzajúcej expozícii liečbe anti-TNF alfa. (15)
Rovnako vedolizumabom indukované endoskopické zlepšenie a endoskopická remisia bola vyššia u anti-TNF alfa naivných pacietov v porovnaní s pacientmi, u ktorých bola liečba vedolizumabom až druholíniová.(16) Včasná liečba vedolizumabom je asociovaná aj so znížením potreby chirurgickej intervencie u pacientov s CD, ktorí horšie odpovedajú na liečbu.(17) Dlhodobá liečba vedolizumabom u pacientov s komplexnou CD viedla u 1/3 responderov k uzavretiu fistúl na konci udržiavacej fázy liečby a ešte väčšie percento pacientov dosiahlo uzavretie fistúl v týždni 52.(18) Pri výbere vhodnej liečby u jednotlivých pacientov hrá dôležitú úlohu aj bezpečnostný profil biologík, z čoho vychádza vedolizumab ako liek s priaznivým bezpečnostným profilom (US VICTORY consortium).(14) Aj štúdia EVOLVE porovnávala výskyt nežiaducich účinkov a infekčných komplikácií vedolizumabu vs anti-TNF alfa v prospech vedolizumabu.(13) Záverom treba zdôrazniť potrebu stratifikácie rizika nepriaznivého priebehu u pacientov s CD a podľa toho manažovať liečbu u každého pacienta jednotlivo. (5) Včas zahájená liečba anti-TNF alfa biologikami je asociovaná s nižšou potrebou chirugickej intervencie a spomalením progresie CD.(6,7,8) Endoskopická odpoveď, endoskopická remisia aj slizničné hojenie u pacientov liečených vedolizumabom je výraznejšie u biologicky naivných pacientov.(15,16)
Referencie
Dátum prípravy: október 2021
C-APROM/SK/ENTY/0115
ENTYVIO® 300 MG PRÁŠOK NA PRÍPRAVU INFÚZNEHO KONCENTRÁTU – VEDOLIZUMAB
Skrátená informácia o lieku
Názov lieku: Entyvio 300 mg prášok na prípravu infúzneho koncentrátu. Zloženie: Každá injekčná liekovka obsahuje 300 mg vedolizumabu. Po rekonštitúcii obsahuje každý mililiter 60 mg vedolizumabu. Úplný zoznam pomocných látok pozrite v SPC. Indikácie: Liečba stredne ťažkej až ťažkej formy aktívnej ulceróznej kolitídy alebo stredne ťažkej až ťažkej formy aktívnej Crohnovej choroby u dospelých pacientov, ktorí mali na konvenčnú liečbu alebo na liečbu antagonistom tumor nekrotizujúceho faktoru alfa (tumour necrosis factor alpha, TNF α) neprimeranú odpoveď,,alebo u ktorých došlo k strate odpovede, alebo ktorí neznášali takúto liečbu. Dávkovanie a spôsob podávania: Odporúčaný dávkovací režim Entyvia je 300 mg podaného intravenóznou infúziou v nultý, druhý a šiesty týždeň a potom každých osem týždňov. Ulcerózna kolitída: Liečba u pacientov s ulceróznou kolitídou sa má ukončiť, ak sa do 10. týždňa nepozorovali žiadne dôkazy prínosu liečby. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Crohnova choroba: Dávka v 10. týždni môže byť prínosom pre pacientov s Crohnovou chorobou, u ktorých nebola pozorovaná odpoveď. V liečbe reagujúcich pacientov sa má pokračovať každých osem týždňov, počnúc 14. týždňom. Ak sa do 14. týždňa nepozorovali žiadne dôkazy prínosu liečby, liečba pacientov s Crohnovou chorobou sa má ukončiť. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Ak sa liečba preruší a je potrebné liečbu obnoviť, je možné zvážiť dávkovanie každé štyri týždne. Bezpečnosť a účinnosť vedolizumabu u detí vo veku od 0 do 17 rokov neboli doteraz stanovené. U starších pacientov nie je potrebné upraviť dávkovanie. Entyvio je určené len na intravenózne použitie ako intravenózna infúzia po dobu 30 minút. Pred podaním sa má rekonštituovať a ďalej nariediť (pozrite v SPC). Kontraindikácie: Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Aktívne závažné infekcie, ako sú tuberkulóza (TBC), sepsa, cytomegalovírusová infekcia, listerióza, a oportúnne infekcie, ako je progresívna multifokálna leukoencefalopatia (PML). Osobitné upozornenia a opatrenia pri používaní: Všetci pacienti musia byť nepretržite sledovaní počas každej infúzie a tiež po dobu približne jednej hodiny (dvoch hodín počas prvých dvoch infuzií) po ukončení infúzie. Boli hlásené reakcie súvisiace s podaním infúzie (infusion-related reactions, IRR) a príznaky precitlivenosti. Existuje možné zvýšené riziko oportúnnych infekcií alebo infekcií, pre ktoré je črevo ochrannou bariérou. Pred začiatkom liečby pacienti musia byť vyšetrení na tuberkulózu. Ak existuje podozrenie na PML, liečba sa musí pozastaviť; ak sa podozrenie potvrdí, liečba sa musí natrvalo ukončiť. Neodporúča sa súbežné používanie vedolizumabu s biologickými imunosupresívami. Pacienti liečení vedolizumabom môžu pokračovať v liečbe neživými vakcínami. Chrípková vakcína sa má podávať injekčne, v súlade s rutinnou klinickou praxou. Ostatné živé vakcíny sa môžu podávať súbežne s vedolizumabom len vtedy, ak ich prínos výrazne prevažuje nad rizikom. Vedolizumab podávaný pacientom, ktorí nie sú súbežne liečení kortikosteroidmi, môže byť menej účinný pre vznik remisie Crohnovej choroby v porovnaní s pacientmi, ktorí už súbežne dostávali kortikosteroidy. Liekové a iné interakcie: Súbežné podávanie kortikosteroidov, imunomodulátorov a aminosalicylátov nemalo klinicky významný vplyv na farmakokinetiku vedolizumabu. Živé vakcíny, najmä živé perorálne vakcíny, je potrebné používať opatrne, ak sa súbežne s nimi podáva Entyvio. Fertilita, gravidita a laktácia: Ženy vo fertilnom veku majú používať primeranú antikoncepciu na zabránenie gravidity a pokračovať v jej používaní aspoň počas 18 týždňov od poslednej liečby. Ako preventívne opatrenie sa odporúča vyhnúť sa používaniu Entyvia počas gravidity, ak prínos jasne neprevažuje nad akýmkoľvek možným rizikom pre matku aj plod. Účinok vedolizumabu na dojčatá nie je známy. Pri používaní vedolizumabu u dojčiacich žien sa má zvážiť prínos liečby pre matku a možné riziko pre dojča. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje: Entyvio môže mať malý vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje, keďže u malého počtu pacientov boli hlásené závraty. Nežiaduce účinky: Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (ako napríklad nazofaryngitída, infekcia horných dýchacích ciest, bronchitída, chrípka a sinusitída), bolesť hlavy, nauzea, horúčka, únava, kašeľ, bolesť kĺbov. Reakcie súvisiace s podaním infúzie boli hlásené u 4 % pacientov. V štúdiách boli hlásené závažné infekcie, ktoré zahrňujú tuberkulózu, sepsu (niektoré smrteľné), salmonelovú sepsu, listériovú meningitídu a cytomegalovírusovú kolitídu. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie: Uchovávajte v chladničke (2 °C – 8 °C). Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom. Rekonštituovaný alebo nariedený roztok nezuchovávajte v mrazničke. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Liek je viazaný na lekársky predpis s obmedzením predpisovania. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Dátum poslednej aktualizácie SPC: 20.2.2019. Dátum vypracovania/poslednej aktualizácie reklamy: október 2019.
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421220602600.
Názov lieku: Entyvio 300 mg prášok na prípravu infúzneho koncentrátu. Zloženie: Každá injekčná liekovka obsahuje 300 mg vedolizumabu. Po rekonštitúcii obsahuje každý mililiter 60 mg vedolizumabu. Úplný zoznam pomocných látok pozrite v SPC. Indikácie: Liečba stredne ťažkej až ťažkej formy aktívnej ulceróznej kolitídy alebo stredne ťažkej až ťažkej formy aktívnej Crohnovej choroby u dospelých pacientov, ktorí mali na konvenčnú liečbu alebo na liečbu antagonistom tumor nekrotizujúceho faktoru alfa (tumour necrosis factor alpha, TNF α) neprimeranú odpoveď,,alebo u ktorých došlo k strate odpovede, alebo ktorí neznášali takúto liečbu. Dávkovanie a spôsob podávania: Odporúčaný dávkovací režim Entyvia je 300 mg podaného intravenóznou infúziou v nultý, druhý a šiesty týždeň a potom každých osem týždňov. Ulcerózna kolitída: Liečba u pacientov s ulceróznou kolitídou sa má ukončiť, ak sa do 10. týždňa nepozorovali žiadne dôkazy prínosu liečby. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Crohnova choroba: Dávka v 10. týždni môže byť prínosom pre pacientov s Crohnovou chorobou, u ktorých nebola pozorovaná odpoveď. V liečbe reagujúcich pacientov sa má pokračovať každých osem týždňov, počnúc 14. týždňom. Ak sa do 14. týždňa nepozorovali žiadne dôkazy prínosu liečby, liečba pacientov s Crohnovou chorobou sa má ukončiť. Zvýšenie frekvencie dávkovania na 300 mg každé štyri týždne môže byť prínosom pre niektorých pacientov, u ktorých došlo k zníženiu odpovede. Ak sa liečba preruší a je potrebné liečbu obnoviť, je možné zvážiť dávkovanie každé štyri týždne. Bezpečnosť a účinnosť vedolizumabu u detí vo veku od 0 do 17 rokov neboli doteraz stanovené. U starších pacientov nie je potrebné upraviť dávkovanie. Entyvio je určené len na intravenózne použitie ako intravenózna infúzia po dobu 30 minút. Pred podaním sa má rekonštituovať a ďalej nariediť (pozrite v SPC). Kontraindikácie: Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok. Aktívne závažné infekcie, ako sú tuberkulóza (TBC), sepsa, cytomegalovírusová infekcia, listerióza, a oportúnne infekcie, ako je progresívna multifokálna leukoencefalopatia (PML). Osobitné upozornenia a opatrenia pri používaní: Všetci pacienti musia byť nepretržite sledovaní počas každej infúzie a tiež po dobu približne jednej hodiny (dvoch hodín počas prvých dvoch infuzií) po ukončení infúzie. Boli hlásené reakcie súvisiace s podaním infúzie (infusion-related reactions, IRR) a príznaky precitlivenosti. Existuje možné zvýšené riziko oportúnnych infekcií alebo infekcií, pre ktoré je črevo ochrannou bariérou. Pred začiatkom liečby pacienti musia byť vyšetrení na tuberkulózu. Ak existuje podozrenie na PML, liečba sa musí pozastaviť; ak sa podozrenie potvrdí, liečba sa musí natrvalo ukončiť. Neodporúča sa súbežné používanie vedolizumabu s biologickými imunosupresívami. Pacienti liečení vedolizumabom môžu pokračovať v liečbe neživými vakcínami. Chrípková vakcína sa má podávať injekčne, v súlade s rutinnou klinickou praxou. Ostatné živé vakcíny sa môžu podávať súbežne s vedolizumabom len vtedy, ak ich prínos výrazne prevažuje nad rizikom. Vedolizumab podávaný pacientom, ktorí nie sú súbežne liečení kortikosteroidmi, môže byť menej účinný pre vznik remisie Crohnovej choroby v porovnaní s pacientmi, ktorí už súbežne dostávali kortikosteroidy. Liekové a iné interakcie: Súbežné podávanie kortikosteroidov, imunomodulátorov a aminosalicylátov nemalo klinicky významný vplyv na farmakokinetiku vedolizumabu. Živé vakcíny, najmä živé perorálne vakcíny, je potrebné používať opatrne, ak sa súbežne s nimi podáva Entyvio. Fertilita, gravidita a laktácia: Ženy vo fertilnom veku majú používať primeranú antikoncepciu na zabránenie gravidity a pokračovať v jej používaní aspoň počas 18 týždňov od poslednej liečby. Ako preventívne opatrenie sa odporúča vyhnúť sa používaniu Entyvia počas gravidity, ak prínos jasne neprevažuje nad akýmkoľvek možným rizikom pre matku aj plod. Účinok vedolizumabu na dojčatá nie je známy. Pri používaní vedolizumabu u dojčiacich žien sa má zvážiť prínos liečby pre matku a možné riziko pre dojča. Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje: Entyvio môže mať malý vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje, keďže u malého počtu pacientov boli hlásené závraty. Nežiaduce účinky: Najčastejšie hlásenými nežiaducimi reakciami sú infekcie (ako napríklad nazofaryngitída, infekcia horných dýchacích ciest, bronchitída, chrípka a sinusitída), bolesť hlavy, nauzea, horúčka, únava, kašeľ, bolesť kĺbov. Reakcie súvisiace s podaním infúzie boli hlásené u 4 % pacientov. V štúdiách boli hlásené závažné infekcie, ktoré zahrňujú tuberkulózu, sepsu (niektoré smrteľné), salmonelovú sepsu, listériovú meningitídu a cytomegalovírusovú kolitídu. Hlásenie podozrení na nežiaduce reakcie: Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom Štátneho ústavu pre kontrolu liečiv, Sekcia bezpečnosti liekov a klinického skúšania, Kvetná 11, 825 08 Bratislava 26, tel.: + 421 2 507 01 206, fax: + 421 2 507 01 237, internetová stránka: http://www.sukl.sk/sk/bezpecnost-liekov. Špeciálne upozornenia na uchovávanie: Uchovávajte v chladničke (2 °C – 8 °C). Uchovávajte injekčnú liekovku vo vonkajšom obale na ochranu pred svetlom. Rekonštituovaný alebo nariedený roztok nezuchovávajte v mrazničke. Podmienky alebo obmedzenia týkajúce sa výdaja a použitia: Liek je viazaný na lekársky predpis s obmedzením predpisovania. Držiteľ rozhodnutia o registrácii: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Dátum poslednej aktualizácie SPC: 20.2.2019. Dátum vypracovania/poslednej aktualizácie reklamy: október 2019.
Pred predpísaním lieku sa oboznámte s úplným znením Súhrnu charakteristických vlastností lieku uvedenom na stránke ŠÚKLu, resp. EMA, alebo dostupnom u lokálneho zástupcu: Takeda Pharmaceuticals Slovakia, s. r. o., Plynárenská 7B Bratislava, 82109 Slovenská republika, Tel: +421220602600.